 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD) Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
Chapitre V: Application à l'oxygène
1. Représentation simplifiée de l'oxygène, selon le modèle de Lewis
Le cas de l'oxygène est très particulier : la couche de Lewis est incomplète (structure "open shell").
Fig. V-1 : Représentation selon Lewis de l'atome d'oxygène et de la molécule
d'O2 résultant de la mise en commun de deux atomes.Sa molécule est paramagnétique (ce qui fut démontré par des mesures faites avec la balance de Gouy et par des études en résonance paramagnétique électronique), ce qui implique la présence d'électrons non appariés. L'oxygène moléculaire possède 12 électrons dans sa couche externe, nombre pair ; son paramagnétisme indique la présence d'électrons non pairés; ceux-ci doivent donc être au nombre de deux.
La couronne de l'atome d'oxygène n'est pas saturée avec ses 6 électrons. Chaque atome d'oxygène peut donc accepter 2 électrons pour stabiliser sa "couronne" : il est donc oxydant. La molécule diatomique O2 possède 12 électrons et peut encore accepter 4 électrons pour être stable (cas de l'eau) : elle est donc très oxydante.En appliquant le principe de Pauli (on ne peut compter au maximum que 2 électrons dans une orbitale), les électrons sont groupés par paires (électrons appariés).
2. Le paramagnétisme de l'oxygène
L'hypothèse de l'existence d'électrons célibataires dans la molécule d'oxygène vient d'une découverte de Faraday : l'oxygène est paramagnétique.
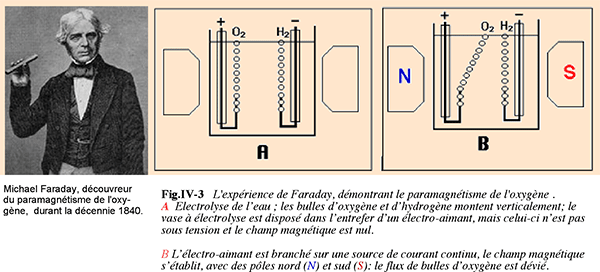
Démonstration de Mulliken : puisque l'oxygène est paramagnétique, il devrait posséder des électrons non appariés. En appliquant la méthode de calcul des orbitales moléculaires, Mulliken a démontré théoriquement la présence des deux électrons célibataires dans la molécule d'O2 fondamental.

3. Explication de l'inertie chimique de l'oxygène fondamental

a) Les règles de restriction de spin
Les règles de restriction (ou de conservation) de spin ont été énoncées en 1929 par le physicien et mathématicien hongrois Wigner et démontrées physiquement en 1931 par Oppenheimer. En voici une version très vulgarisée:
Le nombre d'électrons non appariés doit rester constant avant et après chaque étape d'une réaction.
Nous nous contenterons de retirer de ce difficile chapitre de mécanique quantique des règles pratiques que nous accepterons sans discuter.
Application des règles de sélection de Wigner

b) Application des règles de Wigner à l'oxygène : inertie de l'oxygène fondamental
Comme l'oxygène fondamental est un triplet, nous déduisons de la règle de restriction qu'il est inerte vis-à-vis de la plupart des molécules organiques qui sont des singulets.
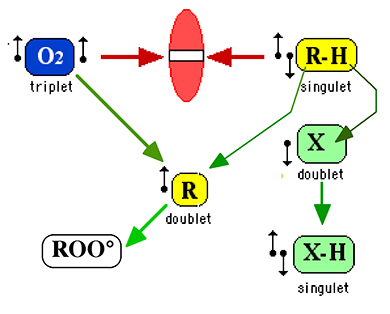
Il nous est maintenant plus aisé de comprendre l'effet oxygène, constaté d'abord par les radiochimistes.
La figure III-10 nous a montré ce qu'est une réaction en chaîne et le mécanisme de dimérisation qui la termine. La création d'un radical oxygéné ROO• relance de nouvelles chaînes, car une dimérisation du type :ROO• + •OOR ==> ROO-OOR
crée un pont tétroxyde extrêmement instable qui peut se rompre de diverses manières dépendant de l'environnement moléculaire et des fonctions portées par la chaîne R.
Par exemple, la réaction suivante est possible :ROO-OOR ===> RO• + O2 + RO•
Les radicaux alcoxyles RO• ainsi formés sont particulièrement réactionnels et prolongent le processus de réactions en chaîne.4. Premières conclusions
a) L'inertie de l'oxygène est bénéfique à la vie
C'est ce qui ressort des affirmations, rédigées de manière un peu naïve, par deux éminents chimistes.

b) Existence d'une biochimie particulière de l'oxygène
L'expression "Métabolisme de l'oxygène" a été utilisée pour la première fois par Mason en 1957 et a suscité un flux d'incompréhension qui dure encore. Pourtant, la vie aérobie ne peut se passer de réactions avec l'oxygène; ces réactions peuvent être dangereuses et doivent être étroitement régulées. Il doit exister de ce fait des mécanismes de contournement des interdictions de spin et d'autres qui limitent les dégagements d'énergie qui peuvent se produire. Certains catalyseurs doivent intervenir pour activer, d'autres pour freiner ces réactions. A la base de ces régulations, on trouve généralement l'intervention de certains métaux dits "de transition" (chapitre VIII). Ces métaux jouent un rôle décisif dans ces lieux de transformation de l'énergie que constitue l'être vivant.
Ces mécanismes de contournement, comme ceux qui limitent leurs effets, sont nombreux et font l'objet d'études en plein essor, mais dont il est très peu question dans les manuels classiques de biochimie. Les connaissances des biologistes restent encore trop parcellaires dans ce domaine qui touche pourtant à tous les grands mécanismes de la vie : production d'énergie, défense de l'organisme, transduction des signaux, etc ... La biochimie de l'oxygène est consacrée à l'étude des moyens offerts aux organismes vivants pour utiliser l'oxygène et des régulations de ces moyens, afin qu'ils ne deviennent pas toxiques.
C'est la matière des chapitres suivants.
5. Bibliographie
Démonstration du paramagnétisme de l'oxygène
Mulliken RS. Life of a Scientist. Springer-Verlag, New York, 1986, p 64-65.Barton DHR, Sawyer DT. Introduction : the dilemmas of O2 and HOOH activation. In :The activation and homogeneous catalytic oxidation. DHR Barton et al., eds. Plenum Press, New York, 1993, p.1.
Courrier