 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
Chapitre VI: Mécanismes de contournement de l'interdiction de spin
Les interdictions quantiques sont franchies par des moyens catalytiques divers, principalement enzymatiques.
1. Réduction de O2 en un doublet par des oxydases
C'est l'oxygène qui est modifié.
L'oxydase permet une fixation du groupement hydroxyle OH d'une molécule H2O sur un substrat X, avec formation d'anion superoxyde.
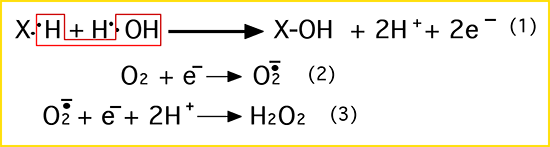
|

Voir les diverses étapes de la réduction de la molécule d'oxygène dans le chapitre VII (fig. VII-1).
2. Transformation du substrat (singulet) en doublet par des deshydrogénases ou oxygénases
C'est le substrat qui est modifié et peut alors réagir avec la molécule •O-O•
Nous avons vu, au chapitre V (fig. V-4), un exemple général de la transformation d'un singulet en doublet sous l'action d'un radical très oxydant, arrachant un atome H• au singulet.
Dans les organismes vivants, ces processus se déroulent sous le contrôle d'enzymes, deshydrogénases et oxygénases, qui font souvent intervenir des métaux de transition (voir chapitre VIII et chapitre IX). La fig. VI-2 montre les mécanismes en jeu, qui transforment le substrat de ces enzymes en doublets, leur permettant de réagir avec l'oxygène fondamental.
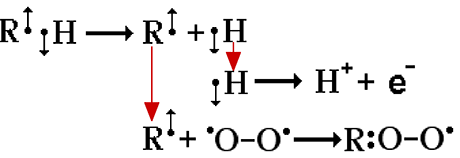
Fig. VI-2 : La molécule organique RH subit l'arrachement d'un atome d'hydrogène, H•, qui instantanément perd son électron en devenant un proton H+. RH est devenu un radical libre R• apte à fixer une molécule d'oxygène fondamental O2 pour former un radical oxygéné
(ROS : Reactive Oxygen Species) du type peroxyl ROO•, très réactionnel (chapitre X).C'est le mécanisme utilisé par les oxygénases qui fixent l'oxygène (une demi ou une molécule) sur une molécule organique rendue préalablement doublet.
3. Cas particulier : flavines et ptérines
Ce sont des molécules qui réagissent directement avec l'oxygène, sans l'aide d'un métal.a) Les structures flaviniques
Elles sont apportées aux mammifères par l'alimentation (riboflavine ou vitamine B2). Elles comportent essentiellement une structure alloxazine :
Fig. VI-3 : Structure générale des isoalloxazines. Remarquer le carbone 4a et l'azote N1 qui sont les points actifs intervenant dans la fixation de l'oxygène fondamental O2. Elles caractérisent les cofacteurs FAD (flavine adénine dinucléotide) et FMN (flavine mononucléotide) de nombreuses enzymes intervenant dans le métabolisme de l'oxygène (oxydases, deshydrogénases et oxygénases). Elles interviennent sans l'intermédiaire d'un métal de transition pour générer H2O2.
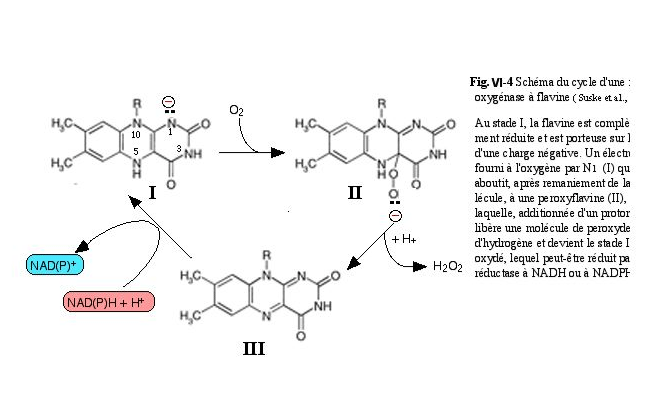
b) Les structures ptéridiniques
Comme les flavines, les ptéridines présentent un hétérocycle comprenant deux azotes en position para. Elles aussi sont capables de fixer une molécule d'oxygène fondamental sans l'intervention d'un métal de transition, pour former de l'anion superoxyde.
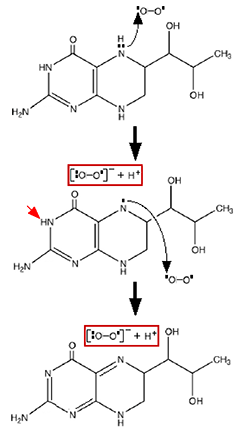
Fig. VI-5 : L'autoxydation d'une ptéridine produit de l'anion superoxyde (d'après Kirsch et al, 2003).
4. Rôle des métaux de transition :
Cette question capitale sera développée au chapitre VIII. Nous nous contentons ici d'admettre que des métaux, comme le fer, le cuivre, le cobalt, le molybdène et les molécules qui les complexent, constituent les parties actives de beaucoup d'oxydases et d'oxygénases. Ces métaux, même à l'état de traces, peuvent activer l'oxygène.
5. Synopsis des voies de contournement
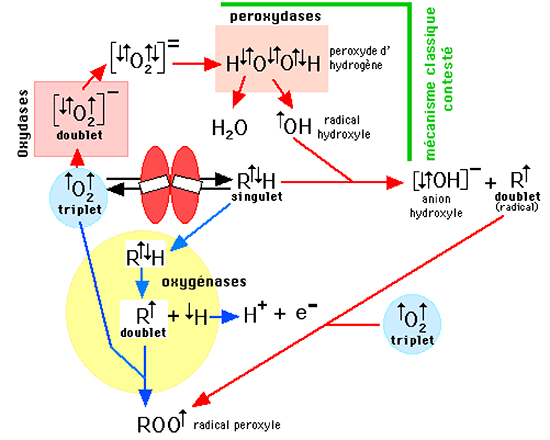
Fig. VI-6 : Deux voies de contournement de l'interdiction de réaction directe d'O2 avec les molécules organiques RH :
• a) la voie des oxydases (partie supérieure de la figure; flèches rouges): la barrière thermodynamique empêchant la première étape de réduction de l'oxygène est franchie grâce à une oxydase, produisant O2• puis, par dismutation, H2O2 ; une nouvelle enzyme, une peroxydase, est requise, transformant cette molécule, encore peu réactionnelle, en espèces oxygénées radicalaires dont l'archétype est le radical hydroxyle •OH ; ces espèces (désignées de plus en plus dans la littérature médicale sous le nom de ROS, reactive oxygen species) réagissent avec les molécules RH en leur enlevant un atome complet d'hydrogène H•, créant ainsi un radical organique R•, qui peut réagir avec l'oxygène pour donner un radical peroxyle ROO•. Voir chapitre IX .
• b) la voie des oxygénases (partie inférieure de la figure; flèches bleues): celle-ci est plus directe. L'enzyme enlève un atome d'hydrogène H•, créant R• qui réagit sans retard au sein de l'enzyme avec une molécule d'oxygène pour former directement ROO•.
6. Activation de O2 en un singulet
Il s'agit d'une réaction très coûteuse en énergie, dont l'existence dans les milieux biologiques est toujours contestée.
Mécanisme :
Fig. VI-7 : Grâce à un apport élevé d'énergie (22 KCal, difficiles à trouver en chimie biologique), les deux électrons célibataires de l'oxygène fondamental s'apparient, ce qui nécessite une inversion de spin expliquant la dépense énergétique élevée. Nous décrivons quelques propriétés de l'oxygène singulet dans le chapitre XI.

7. Bibliographie
Propriétés des flavines
Suske WA, van Berkel WJH, Kohler HPE. Catalytic mechanism of 2-hydroxybiphenyl 3-monooxygenase, a flavoprotein from Pseudomonas azelaica HBP1. Journal of Biological Chemistry, 1999; 274: 33355-33365.Propriétés des ptérines
Kirsch M, Korth HG, Stenert V, Sustmann R, de Groot H. The autoxidation of tetrahydrobiopterin revisited: Proof of superoxide formation from reaction of tetrahydrobiopterin with molecular oxygen. Journal of Biological Chemistry 2003; 278: 24481-24490.
Wei CC, Crane BR, Stuehr D.J. Tetrahydrobiopterin radical enzymes. Chemical Review 2003; 103: 2365-2383.