 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD) Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie : tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
Chapitre XIII: O2 : indispensable à la défense
Avertissement
1. Phénomènes inflammatoires : généralités
Les processus inflammatoires et la production de ROS sont étroitement associés. C'est la raison qui nous incite à développer des généralités sur ces phénomènes, laissant au prochain volume, consacré au rôle des ROS en pathologie, l'étude des cas particuliers que constituent l'ischémie-reperfusion, l'athérosclérose, les arthrites, etc...
Néanmoins, nous ne sortirons pas du cadre de cette initiation au métabolisme de l'oxygène. Nous laisserons de côté, tout en reconnaissant leur extrême importance, l'aspect immunitaire, le rôle des métallloprotéases ainsi que les mécanismes moléculaires (adhésion, transduction du signal, molécules de reconnaissance, etc …) qui dépassent le cadre forcément limité de ce travail.
Nous invitons nos lecteurs à consulter les excellents ouvrages dont nous donnons les références en fin de chapitre.1) Bref rappel sur les bases du concept de l'inflammation
L'inflammation est une réaction de défense contre des agents le plus souvent extérieurs (bactéries), mais parfois intérieurs (processus dégénératifs). Metchnikov résumait le tableau clinique de l'inflammation par les 4 symptômes : rubor (rougeur), tumor (gonflement), calor (échauffement) et dolor (douleur). Ce synopsis est toujours d'actualité, mais les mécanismes sont toujours en cours d'élucidation.
La première manifestation d'une réponse à une agression (pénétration d'une bactérie dans la peau, par ex.) est l'accroissement de la circulation locale par vasodilatation, provoquant rougeur et échauffement; le gonflement est dû à l'arrivée et à l'accumulation des cellules blanches du sang, les leucocytes, ainsi qu'à un œdème provoqué par l'augmentation de perméabilité des capillaires et une entrée de liquide chargé de protéines (surtout d'albumine plasmatique); quant à la douleur, elle est produite par la distension des tissus œdématiés et la sécrétion par certains leucocytes de substances algogènes, comme la substance P et certaines prostaglandines.
Nous ne nous occuperons, dans ce chapitre XIII, que de l'aspect du métabolisme de l'oxygène qui domine tous les processus pathologiques dans les phénomènes inflammatoires. Ce sont les leucocytes qui sont les sièges les plus importants de la production d'espèces oxygénées activées.2) Rôle de l'immunité humorale dans l'activation des leucocytes
Au départ, avant l'activation, intervient une grosse protéine, le complément, qui libérera une série de fragments protéasiques et non protéasiques (C1, C5a, etc ...).
L'immunité humorale est la synthèse et la libération dans le sang de grosses protéines, les anticorps, par réaction de l'organisme à l'entrée d'une structure étrangère, généralement organique, l'antigène. Les anticorps sont synthétisés selon des informations en provenance des cellules immunologiquement compétentes qui ont "démonté" l'antigène. Quelques jours après l'entrée de l'antigène, il existe suffisamment d'anticorps spécifiques de cet antigène pour réagir avec lui en formant le complexe immun antigène-anticorps qui initie un système non spécifique, désigné globalement sous le nom de voie du complément. Cette voie consiste en une cascade de clivages protéolytiques du complément initial et fut la première à être découverte. De ce fait, elle est qualifiée de classique. La cascade peut être activée également par des lectines (osides) et constitue alors la voie des lectines. Une troisième voie, dite alterne, est déclenchée par des facteurs d'origine bactérienne. Dans les 3 voies, des peptides provenant de l'attaque protéolytique du complément sont libérés, et notamment le C3a et le C5a (anaphylatoxine) qui attirent (chimiotaxie) et activent les 3 types de cellules de défense décrits au paragraphe suivant et, de ce fait, déclenchent indirectement la production de ROS par ces éléments.3) Cellules participant à l'inflammation
a) Principaux leucocytes se trouvant dans le sang
Les leucocytes sont les cellules blanches (par opposition aux cellules rouges que sont les hématies ou globules rouges). Les leucocytes sont beaucoup moins nombreux que les hématies (5 à 8000 contre 5.000.000 par mm3 de sang).
On les classe en 2 catégories :
1. Les cellules à noyau non lobé (mononucléaires) se classant en :
monocytes : cellules grandes (30 à 40 microns), nanties d'un cytoplasme apparent, capables de se transformer en très grandes cellules après stimulation par des facteurs inflammatoires : les macrophages (fig. XIII-1) qui migrent hors du flux circulatoire par diapédèse.
lymphocytes : cellules plus petites (10 à 20 microns), classées aujourd'hui selon leurs capacités immunologiques (ce qui dépasse le cadre de cette introduction).
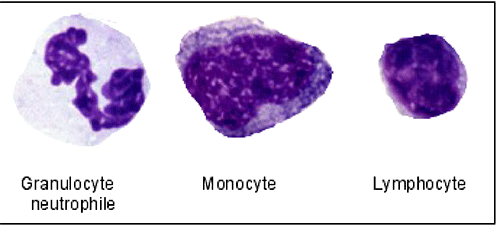
Fig. XIII-1 : Les 3 types de cellules blanches sanguines ou leucocytes.
2. Cellules à noyau multilobé (noyaux apoptotiques), baptisés par les premiers hématologues "polynucléaires" (actuellement polymorphonucléaires), constituant la phase ultime d'une longue maturation dans la moëlle osseuse (au même titre que les hématies). Contrairement aux hématies qui ont une durée d'existence de 100 jours lors de leur entrée dans la circulation, les polymorphonucléaires vivent leurs dernières heures de vie dans le sang circulant. Ces éléments contiennent des granulations (lysosomes) qui les font dénommer aussi "granulocytes". Selon les affinités des granulations vis-à-vis des colorants aniliniques (Romanovsky) qui correspondent à des propriétés biochimiques différentes, on distingue :
- les polynucléaires neutrophiles (PMN) contenant de très petites granulations captant un composant neutre des mélanges de Romanovsky, l'azur II, de couleur bleu clair. Ils représentent 75% des leucocytes circulants.
- les polynucléaires éosinophiles qui contiennent des granulations plus grosses que les premiers, fixant l'éosine des mélanges de Romanovsky, ce qui leur donne une coloration rose. Ils représentent moins de 2 % des leucocytes totaux.
- les polynucléaires basophiles dont les gros granules fixent le bleu de méthylène des mélanges de Romanovsky et qui ne constituent que 0,5 % de l'ensemble des leucocytes circulants.b) Chimiotaxie, diapédèse et phagocytose
Les monocytes et les polymorphonucléaires (PMNs) sont sensibles aux substances émanant de tissus malades situés dans le voisinage des canaux sanguins. Les PMNs ainsi que les monocytes devenus macrophages sous l'effet de ces facteurs sont capables de s'insinuer entre les jonctions des cellules endothéliales tapissant les canaux sanguins et d'émigrer dans les tissus sous-jacents où se trouve le foyer d'où émanent les facteurs excitants; c'est le phénomène de diapédèse et l'attirance chimique vers les centres inflammatoires émetteurs est dénommée chimiotaxie ou leucotaxie. On connaît maintenant de nombreux facteurs bien isolés et déterminés chimiquement qui attirent les leucocytes (cytokines, leucotriènes, C3a, C5a, etc …); ce sont des petits peptides ou des molécules de nature lipidique dont l'étude ne sera pas abordée dans le cadre de cette introduction à la biochimie de l'oxygène.

Fig. XIII-4 : Formation d'un phagosome dans un macrophage.
4) Signaux d'alerte émis par le macrophage
Lorsqu'ils sont activés, les monocytes libèrent dans le milieu extracellulaire des peptides activateurs de diverses fonctions cellulaires, les cytokines. Devenus macrophages, les monocytes continueront à assumer cette fonction excitatrice. Deux d'entre ces molécules sont particulièrement importantes dans les phénomènes qui nous intéressent : l'interleukine -1 (IL-1) et le Tumor Necrosing Factor alpha (TNF-α). Toutes deux activent non seulement les autres monocytes, mais aussi les polynucléaires neutrophiles. L'activation par cytokines a un effet boule-de-neige, elle a une nature amplificatrice. Un seul monocyte activé peut ainsi rameuter de très nombreuses autres cellules de défense. Souvent, l'effet favorable est dépassé (pompiers pyromanes) et le processus défensif devient dangereux pour l'organisme. Ce phénomène pathologique sera traité dans le deuxième tome, L'oxygène en pathologie des mammifères.
5) La flambée respiratoire (respiratory burst)
a. Découverte d'un phénomène insolite en 1959
En 1959, Sbarra et Karnovski découvrirent que la surconsommation d'oxygène durant la phagocytose, constatée dès 1933 par Balbridge et Gérard, était insensible au cyanure millimolaire. L'oxygène surconsommé n'était donc pas réduit par la cytochrome oxydase (respiration classique). Cet accroissement remarquable, insensible au KCN, fut dénommé respiratory burst ou flambée respiratoire. Sbarra et Karnovski montrèrent également l'existence d'une forte activation du shunt des hexose-monophosphates (HMS) dans les phagocytes activés, ce qui impliquait un important "turn-over" du NADPH.
Fig. XIII-5 : Schéma d'un Oxygraph permettant la mesure des variations de concentration en oxygène dans
une suspension de leucocytes. Il permet de démontrer l'existence de la flambée respiratoire (fig. XIII-6).Depuis 1959, une série de découvertes se sont succédées : la respiratory burst produit H2O2, vraisemblablement par un mécanisme enzymatique (Iyers, 1961). L'hypothèse enzymatique fut confirmée par Rossi (1964) qui démontra que cette enzyme était dépendante du NADPH fourni par l'activation du HMS. Paul et Sbarra (1968) déterminèrent que la production d'H2O2 est quadruplée chez les polynucléaires neutrophiles au cours de la phagocytose, ce phénomène étant en rapport avec les activités bactéricides de ces leucocytes. Simultanément, Klebanoff (1968) établit que la myéloperoxydase (MPO), enzyme caractéristique des polynucléaires neutrophiles (Agner, 1941), utilise H2O2 formé pour produire, en présence d'ions Cl-, des espèces chlorées très oxydantes.
La triade MPO/H2O2/halogénure était découverte.
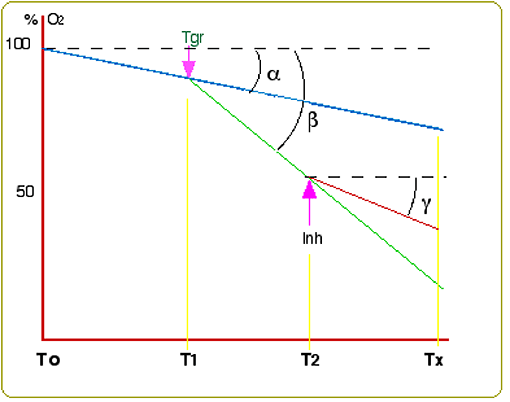
| Fig. XIII-6 : L' "Oxygraph" enregistre les variations de la teneur en O2 (en %, ordonnées) en fonction du temps (abscisses). Sur ce graphique, démonstration par l'"Oxygraph" de la flambée respiratoire dans une population de cellules (ici des monocytes THP-1). Ces cellules, se trouvant dans une enceinte close, consomment l'oxygène en fonction de leur nombre et de leur état métabolique. Sans agent modificateur, la consommation est exprimée par une droite bleue de pente α (respiration mitochondriale). Si, au temps T1, on injecte un déclencheur Tgr (trigger) de la flambée respiratoire, la consommation s'accroît fortement selon une droite verte de pente β. Cette hyperconsommation peut être ralentie par un inhibiteur spécifique (Inh) de la flambée, administré au temps T2, et une nouvelle droite rouge, de pente γ, exprime cette inhibition, γ étant faiblement supérieur à α. Ici, Tgr est le phorbol myristate acétate et l'inhibiteur Inh est le diphényl iodonium. |
C'est en 1972 que l'enzyme productrice d'H2O2 fut isolée par Rossi et collaborateurs qui lui donnèrent le nom de NADPH-oxydase. En 1972, Rossi et al. mirent en évidence la formation d'anion superoxyde, précurseur immédiat d'H2O2, au cours de l'activité de la NADPH-oxydase.
Dès le milieu de la décennie 1970 commencèrent de nombreux travaux mettant progressivement en évidence le rôle de la protéine kinase C dans la transduction du signal, allant du récepteur membranaire à l'activation du système NADPH-dépendant, produisant O2• (Myers et coll., 1985). Durant les décennies 80 et 90, on découvrit que la NADPH oxydase est multiprotéique. Grâce aux travaux de biologie moléculaire s'appuyant sur l'étude du DNA de patients souffrant de granulomatose (dont les leucocytes ne font pas de respiratory burst) et de souris "knock-out" ne synthétisant pas certaines des protéines impliquées dans la NADPH oxydase, on a pu déterminer quelles étaient les protéines indispensables et les protéines adjuvantes.
Au cours du contact avec un agent activateur, divers récepteurs membranaires permettant la reconnaissance sont impliqués.b. Causes de la flambée respiratoire
On distingue deux types d'excitation de la cellule apte à entrer en flambée respiratoire :
a) La modification du terrain ou priming qui est une préparation de la cellule à assumer pleinement ses fonctions de phagocyte et de générateur de ROS. Divers agents, agissant à faible concentration, "préparent" ainsi le monocyte. Cette "préparation" exige un certain nombre d'heures. En général, on constate une transformation de la cellule mobile en macrophage, avec émission de cytokines. Toutefois, la respiration insensible au KCN n'est que peu augmentée.
b) Le déclenchement de la flambée ou triggering par des agents de priming à forte concentration ou par des facteurs d'origine immunologique (C5a). Des cytokines comme le TNF-α sont des agents déclencheurs puissants.
On remarque que les monocytes non "préparés" (non soumis au priming) entrent en flambée respiratoire au contact des agents déclencheurs cités ci-dessus. Mais l'intensité de la réponse est beaucoup plus faible que celle des cellules "préparées".
Comme agents de priming, on peut citer des substances d'origine bactérienne, comme les lipopolysaccharides (LPS) des bactéries Gram-négatives et les heat shock proteins (HSP) des Chlamydia, bactéries endocellulaires.
On peut distinguer les triggers naturels (C3a et C5a, certains petits peptides, les lymphokines) et les triggers artificiels, comme le très utilisé acétate de phorbol myristate (PMA : fig. XIII-8), extrait d'une Euphorbe africaine, ainsi que des agents pharmacologiques mobilisateurs de calcium (ionophore calcique).
c. Mécanisme de l'excitation de la flambée respiratoire
1) Voie naturelle (fig. XIII-7). Un agent stimulant S (C5a, peptide, TNF-α, etc …) se fixe sur un récepteur transmembranaire adéquat R. A partir de là, une cascade d'événements se produit : une protéine kinase transforme un phospholipide qui sera ensuite traité par une phospholipase C, permettant la libération d'un diacylglycérol qui à son tour active un site clé : la protéine C kinase (PKC). Nous verrons au chapitre suivant que cette dernière enzyme permet le rassemblement des sous-unités de la NADPH oxydase, principale enzyme productrice d'anion superoxyde.
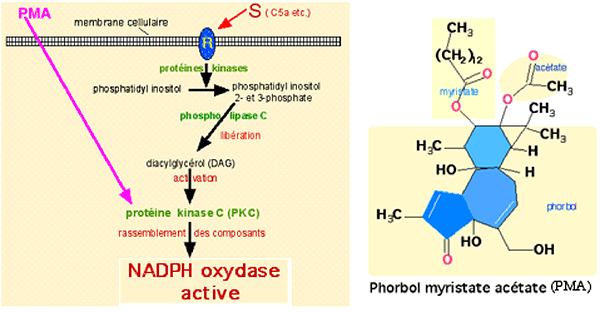
| Fig. XIII-7 : La cascade naturelle de l'activation (en noir) et la voie artificielle (en violet). | Fig. XIII-8 : PMA, excitant direct. |
2) Voie artificielle : elle consiste en l'excitation directe de la PKC, court-circuitant toutes les voies intermédiaires.
Le trigger le plus utilisé pour obtenir ce résultat est le PMA (fig. XIII-8). Le diacylglycérol extra-cellulaire est également un excitant de la PKC, moins toxique que le PMA.
d. Production de ROS à partir d'H2O2
Ce sont les peroxydases qui peuvent attaquer le peroxyde d'hydrogène en produisant des ROS. Dans les cellules de mammifères, ce sont principalement la myéloperoxydase et les dérivés oxydés de l'hémoglobine et de la myoglobine : la methémoglobine et la metmyoglobine. Les mécanismes de ces réactions sont brièvement exposés dans la suite de ce chapitre.
Comme nous l'avons vu au chapitre IX, des ions ferryles pourraient intervenir, mais cette question est encore l'objet de débats passionnés.
2. Les enzymes prooxydantes impliquées dans l'inflammation
a. Enzymes de la "respiratory burst"
1. La NADPH oxydase
Schéma simplifié du processus catalytique :
Il fut assez rapidement établi que la NADPH oxydase est une enzyme multifactorielle, constituée par un noyau de 2 protéines sis dans la membrane des phagosomes: p22phox, gp91phox (phox vient de "phagocyte oxidase"; p : protéine; gp: glycoprotéine). Les autres constituants sont des éléments protéiques solubles se trouvant dans le cytosol voisin du noyau. Comme nous l'avons vu dans le paragraphe précédent, c'est la stimulation de la protéine C kinase (PKC) qui active la NADPH oxydase. Le signal venu de la PKC déterminerait la phosphorylation de la protéine p47phox, suivie du regroupement d'au moins 3 autres protéines autour du groupe transmembranaire : p40phox, p67phox, et une protéine ligante de GTP, soit le Rac1, soit le Rac2. Dès lors, la NADPH oxydase active est constituée (fig. XIII-9).
Le siège de l'activité semble bien localisé dans la protéine gp91phox qui semble contenir tous les centres redox connus à ce jour et qui interviennent dans la flambée respiratoire. Dans cette protéine, on trouve une molécule de FAD liée au cytochrome b558 qui contient deux hèmes.
Cette protéine membranaire constitue donc une chaîne de transport d'électrons, fournis par le NADPH cytosolique, qui traversent la membrane et aboutissent sur un site hémique plongeant dans la cavité du phagosome. Là, ils réduisent une molécule d'oxygène en anion superoxyde (fig. XIII-11). Simultanément, pour chaque électron transporté dans le phagosome, un proton (H+) traverse la membrane par un canal spécial afin que l'équilibre des charges électriques reste inchangé. Le NADPH est régénéré à partir du shunt des hexoses monophosphates ou cycle des pentoses : voir la fig. XIII-10.Remarque: la connaissance de la présence du cytochrome b558 précéda celle de gp91 et de p22. Si l'on est d'accord aujourd'hui sur l'appartenance de b558 à un complexe protéique plus grand, gp91, certaines publications parues avant 1998 continuent de nommer cytochrome b558 l'ensemble gp91+ p22.
Fig. XIII-9 : Eléments du puzzle protéique qu'est la NADPH oxydase.
Au repos, deux éléments sont fixés sur la membrane du phagosome: gp91phox et p22phox. Les 4 autres éléments sont dispersés dans le cytosol. L'excitation de la PKC par un trigger (PMA par exemple) détermine une phosphorylation de p47phox et le rassemblement des 3 autres protéines cytosoliques. L'ensemble s'agrège aux deux protéines membranaires. Le gp91phox, qui contient tous les facteurs actifs du système de la NADPH oxydase, peut alors produire l'anion superoxyde dans le phagosome.Interdépendance enzymatique : la NADPH oxydase est grande consommatrice de NADPH. Il faut que la cellule dispose, soit d'une NADP+ réductase, soit d'une voie métabolique comme le cycle des pentoses (ou shunt des hexoses monophosphates HMS), comme c'est le cas dans les polymorphonucléaires neutrophiles lors de la "respiratory burst".
Fig. XIII-10 : HMS hexose monophosphate shunt : le shunt des hexoses-monophosphates régénère le NADPH qui fournit un H+ et un électron à la NADPH oxydase (schéma extrêmement simplifié).
Fig. XIII-11 : Schéma général du mécanisme d'action d'une NADPH oxydase activée : le transfert d'un électron passe par une molécule de FAD puis par le système du cytochrome b558 pour aboutir dans le milieu phagosomique où l'électron réduit une molécyle d'oxygène en anion superoxyde. Simultanément, un proton H+ est transféré dans le phagosome par un canal spécial, équilibrant la charge électrique négative. La famille des NADPH oxydases
Cinq enzymes répondant aux caractéristiques fonctionnelles d'une NADPH oxydase ont été identifiées et groupées sous l'abréviation NOX (superoxide-producing NAD(P)H oxidase). De plus, 2 enzymes d'origine thyroïdienne ont été décrites comme très voisines des NOX. Mais comme elles manifestent en plus une activité peroxydasique, elles ont été nommées Duox 1 et Duox 2 (Dual oxydases). Le cadre de cette introduction étant limité, cette famille sera étudiée en détail dans un des chapitres du tome 2 de l'Initiation : L'oxygène en pathologie des mammifères.La myéloperoxydase, localisée dans les granules azurophiles des granulocytes neutrophiles, est une enzyme hémique (voir chapitre IX). Elle a la propriété de former, à partir de H2O2, de l'hypochlorite ClO- (eau de Javel) qui est considéré comme l'oxydant le plus énergique produit par le granulocyte activé.
H2O2 + Cl- ===> ClO- + H2O
HOCl réagit rapidement avec une grande variété de molécules biologiques telles que les protéines, les peptides, les lipides, le cholestérol, le DNA et divers aminoacides; il réagit avec des amines pour produire des chlorures d'amines très oxydants, mais plus sélectifs que HOCl, et de ce fait, ne réagissant pas sur place comme ce dernier.R-NH2 + ClO- ===> R-NHCl + HO-
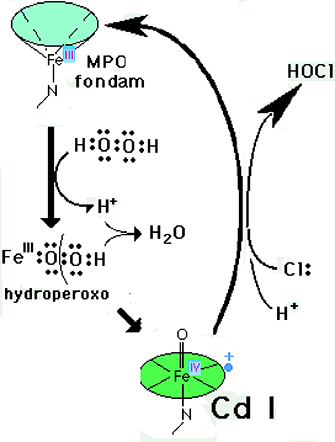
Fig. XIII-12 : Mécanisme peroxydasique de la formation de HOCl.
HClO et les chlorures d'amine réagissent avec les thiols (méthionine et cystéine) pour former des sulfoxydes R-S=O et des oxyacides. Une réaction importante est la chloration de la tyrosine et des résidus tyrosyles qui jouent un grand rôle dans la transmission des signaux ( fig. XIII-13):
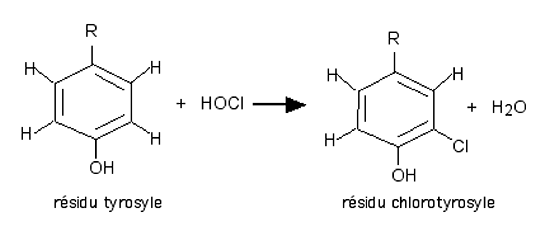
Fig. XIII-13 : Chloration d'un résidu tyrosyle.
Les travaux de Baldus (2002) ont montré, d'autre part, qu'en présence de nitrite (provenant de NO• formé par la NO• synthase), la myéloperoxydase catalyse la formation de nitrotyrosine durant les processus inflammatoires.
Les NO synthases produisent le monoxyde d'azote NO•, lequel réagit avec l'anion superoxyde pour former le peroxynitrite ONOO- (voir chapitre VII). Les NO synthases figurent ainsi au nombre des enzymes pro-inflammatoires agissant par création de ROS.
Fig. XIII-14 : Vue synthétique de l'activité d'une NO synthase.
Une molécule d'arginine est oxydée par une NO synthase en citrulline et monoxyde d'azote NO•.
Fig. XIII-15 : Structure générale des NO synthases : enzymes intracellulaires dimériques. Dans chaque dimère, on distingue le domaine de l'oxygénase, protéine hémique, celui de la réductase, un pont protéique unissant les deux protéines globulaires et une partie qui fixe la calmoduline placée entre les deux domaines, au voisinage du pont. C'est dans le domaine de l'oxygénase que se trouve l’hème, site actif où se forme le NO• aux dépens de la L-arginine. La tétrahydrobioptérine (BH4) joue un rôle modérateur encore mal défini. Le domaine des réductases contient le flavine mononucléotide (FMN) et le flavine adénine dinucléotide (FAD). Ce domaine fournit les électrons nécessaires à la production de NO• (fig. XIII-16 : 5 e- par molécule de NO•). Ceux-ci sont fournis par l'oxydation de 2,5 molécules de NADPH, chacune libérant 2 e-.
Fig. XIII-16 : Le transport des 5 électrons au cours de la synthèse de NO•.Régulation des NO Synthases
Leur fonctionnement est déclenché par la présence de calmoduline-Ca2+ (fig. XIII-16) et est inhibé par le NO• lui-même qui se fixe sur l’hème ferrique ou ferreux et bloque l’enzyme de manière réversible (effet "feed-back"). Ce phénomène se produit dès le début de la synthèse du NO• et induit un état stationnaire de fonctionnement enzymatique (« steady state »). La présence d'O2, de BH4 et de L-arginine en quantité suffisante limite cet effet.
Le BH4 a un rôle régulateur essentiel: en son absence ou lorsqu'il est en concentration insuffisante, la NOS produit l’anion superoxyde (et H2O2) qui, avec NO•, peut donner le peroxynitrite, très oxydant, ONOO-.
Les inhibiteurs connus les plus anciens sont le bleu de méthylène et les hémoprotéines. La NOS est également inhibée par les analogues de la L-Arg comme la NG-monométhyl-arginine (L-NMMA). On signale l'existence d'inhibiteurs spécifiques de la NOS inductible qui n'atteindraient pas la NOS constitutive : l'aminoguanidine, la S-methylisothiourée, la mercapto-éthylguanidine.Un mythe vivace : l'existence de NO• "libre" après sa formation
Nous avons vu (chapitre VII) que NO• réagit très rapidement avec l'oxygène pour former du dioxyde d'azote NO2•. L'oxygène est considéré jusqu'à présent comme un élément diffusant sans problème dans les milieux extra- et intracellulaires. Il est donc très probable que la durée de vie de NO•, dans un tissu oxygéné, soit très éphémère. Pourtant, nombreux sont les chercheurs, médecins et biologistes, qui croient toujours que le NO• formé par une NOS sort dans le milieu intercellulaire et peut aller agir dans d'autres cellules. Un conférencier est allé jusqu'à affirmer qu'une des fonctions des muqueuses des sinus maxillaires est de produire du NO• qui facilite la broncho-dilatation !
Pourtant, Ignarro qui fut le premier chercheur à avoir mis en évidence, en 1979, un lien étroit, sinon l'identité, entre l'EDRF ("Endothelium-Derived Relaxing Factor"), ce mystérieux facteur de relaxation des fibres musculaires lisses, et le NO•, admettait en 1996, bien après l'obtention de son prix Nobel, que le NO• pouvait n'être qu'un "précurseur labile" de facteurs nitrés physiologiquement actifs.
Dès 1996, une équipe européenne présenta à l'Académie des Sciences des USA une communication au titre profondément sceptique : "No NO• from NO synthase". Fait remarquable, ce travail était parrainé par le Prix Nobel Robert F. Furchgott, autre découvreur de la formation de NO• in vivo. Les auteurs de cette communication avaient voulu démontrer, par méthode directe, l'apparition du NO•, mais en vain.
Il est probable qu'immédiatement après sa libération, le monoxyde d'azote forme un composé relativement labile avec une molécule telle qu'un thiol, pour former un singulet ne pouvant réagir avec l'oxygène. Cette molécule nitrée agirait à la manière d'un "donneur de NO•", apte à libérer cet oxyde au contact direct d'un site spécifique.b. Autres enzymes oxydantes de l'inflammation
1. Cyclooxygénases : activités peroxydasiquesDès 1975, Marnett a remarqué que durant l'activité de la cyclooxygénase, l'oxydation de divers substrats pouvait se produire dans le milieu où fonctionnait l'enzyme (similitude avec la cytochrome P450 oxydase). Cette oxydation se produit lorsque CdI retourne au stade fondamental FeIII, via CdII, en captant les électrons de donneurs DH qui deviennent radicalaires (D•). Ainsi se produit l'oxydation de l'acide coumarique en présence de H2O2. Ce composé sert de réducteur en donnant deux électrons. Comme pour les autres peroxydases, des réactions en chaînes peuvent se produire (fig. XIII-17).
Fig. XIII-17 : Le cycle peroxydasique de la PG synthase.
L'exemple choisi ici est l'oxydation de la coumarine CouH. Après sa transformation en radical Cou•, la molécule peut être attaquée par l'oxygène. Cette fonction peroxydasique s'exerce également sur les peroxydes lipidiques.Il s'agit d'oxygénases à fer non hémique (fig. XIII-18 A) qui agissent par arrachement d'un hydrogène H• et fixation d'une molécule d'oxygène (fig. XII-18B). Ces enzymes permettent la peroxydation, sur des sites définis, d'acides gras poly-insaturés à 20 carbones comme l'acide arachidonique. Chez les mammifères, les lipoxygénases produisent des hydroperoxydes de l'acide arachidonique. Peroxydé en C5, l'acide arachidonique est le précurseur d'une famille biologiquement très active, celle des leucotriènes. Ceux-ci sont des messagers agissant sur les fibres musculaires lisses, provoquant notamment des bronchoconstrictions et des vasoconstrictions. Certains sont des agents leucotaxiques puissants ainsi que des triggers de la flambée respiratoire. Peroxydé en C12 et/ou en C15, l'acide arachidonique devient l'acide 12-hydroperoxyeicosatétraènoïque (12-HPETE) ou 15-hydroperoxyeicosatétraènoïque (15-HPETE), également biologiquement actifs.
La fig. XIII-19 détaille la synthèse du 15-HPETE qui peut être transposée aux peroxydations en C5 et C12.
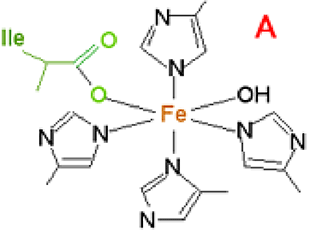
Fig. XIII-18 : A Site actif des lipoxygénases de mammifères. Le fer est complexé par les noyaux imidazoles de 4 molécules d'histidine et par la fonction acide d'une isoleucine Ile.
B Peroxydation d'un acide gras polyinsaturé par une lipoxygénase. Remarquer la conjugaison des doubles liaisons.
Fig. XIII-19 : Peroxydation de l'acide eicosatétraènoïque (acide arachidonique) en 15-HPETE par la 15-lipoxygénase.
3. Xanthine oxydase
La xanthine oxydase (XO) est une métallo-enzyme dont le molybdène constitue le site actif. Elle existe dans les cellules sous la forme de xanthine deshydrogénase (XDH), mais l'oxydation de résidus -SH transforme la XDH en XO, xanthine oxydase, de manière réversible. La différence essentielle entre les deux structures est que l'une, la XDH, utilise NADP+ comme accepteur des 2 électrons provenant de la purine oxydée, tandis que l'autre transfère ces 2 e- à 2 molécules O2. Aujourd'hui, on désigne les deux formes par l'appellation générale xanthine oxydo-réductase (XOR). Les XOR catalysent la dégradation des bases puriques, selon le schéma de la fig. XIII-20.
Il s'agit d'oxydations par l'oxygène fourni par H2O, au cours desquelles deux électrons sont transférés vers un accepteur qui peut être:
- le NADP+, lorsque la XOR est sous la forme XDH (cas normal)
- l'oxygène fondamental O2, lorsque la forme XO prédomine : il se forme alors de l'anion superoxyde.
Fig. XIII-20 : Les 2 mécanismes d'oxydation des purines.
A : oxydation par la forme XDH. L'oxygène est fourni par une molécule d'eau. Les électrons sont acceptés par NADP+.
B : oxydation par la forme XO. L'oxygène est fourni par une molécule d'eau. Les électrons sont acceptés par O2 qui devient l'anion superoxyde.Les xanthine oxydo-réductases sont des associations protéiques complexes comprenant :
a) Le site actif, ou molybdoptérine, où un atome de molybdène est fixé par deux atomes de soufre.
Le molybdène coordonne une molécule d'eau dont l'oxygène, par réaction nucléophile, se fixe sur le site approprié de l'hypoxanthine ou de la xanthine. Le molybdène enlève deux électrons au système purine/eau qui se détache alors du site actif.R-Mo6+ + purine + eau -----> R-Mo4+ + oxypurine
Pour continuer sa fonction catalytique, le molybdène perd deux électrons qui vont être repris par la chaîne de transport et acheminés vers l'accepteur final.
b) La chaîne de transport est assurée par deux protéines à fer et à soufre, puis par une molécule de FADH2, selon le schéma de la fig. XIII-21.
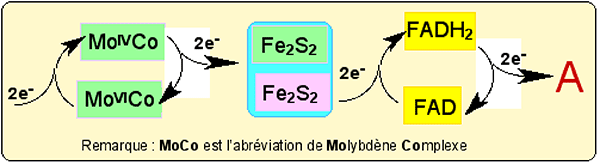
Fig. XIII-21 : Cheminement des 2 électrons e- vers l'accepteur final A. Celui-ci peut-être soit NADP+, soit 2 O2.
Problème de la conversion XDH <===> XO
Cette question reste toujours un problème non résolu in vivo.
In vitro, on obtient la conversion de la XDH en XO par protéolyse (action de l'élastase ou de la trypsine). Il apparaît de plus en plus évident que la conversion est associée à une oxydation de fonctions -SH de la XDH. Ainsi s'explique le rôle de l'hypoxie qui augmente la production d'acide urique, s'accompagnant d'une génération importante d'anion superoxyde. Inversément, un retour de la balance redox cellulaire vers les potentiels négatifs convertirait aisément la XO en XDH.
En bref, les principaux régulateurs de l'expression et de l'activité des XOR semblent être la pression d'oxygène et la production de NO•.
Un regain d'intérêt pour le rôle des XOR dans les affections cardiovasculaires associées à la production de ROS apparaît dans la littérature récente. Ce sujet sera traité dans le tome consacré à l'oxygène en pathologie des mammifères.c. Fonction peroxydasique de dérivés de l'hémoglobine (Hb)
C'est principalement par la voie des ROS, issue de la formation d'ions ferryles, que l'hémoglobine libre est toxique. La fig. XIII-22 montre la similitude des transformations de Hb avec celles des autres hèmes, tel que la méthémoglobine (MetHb) .
Fig. XIII-22 : Cycle redox de la MetHb (comparer avec la fig. XIII-17) ; le réducteur permettant le retour du fer ferryle au fer III est ici le ferrocyanure (FeIICy6)4- qui s'oxyde en (FeIIICy6)3-. Des réducteurs plus biologiques, tels que les thiols, permettent ces cycles. Dans le cas de la metHb, l'usage de l'ascorbate est aléatoire, car les réactions d'oxydation déclenchées amènent souvent la destruction de l'hème.
3. Bibliographie
Flambée respiratoire : histoire
Balbridge CW, Gerard RW. The extrarespiration of phagocytosis. American Journal of Physiology. 1933; 103: 235-236.
Agner K. Verdoperoxidase. A ferment isolated from leucocytes. Acta Physiologica Scandinavica. 1941; 2(S8): 1-62.
Sbarra AJ, Karnovsky ML. The biochemical basis of phagocytosis. I. Metabolic changes during the ingestion of particles by polymorphonuclear leukocytes. Journal of Biological Chemistry. 1959; 234: 1355-1362.
Iyer GYN, Islam MF, Quastel JH. Biochemical aspects of phagocytosis. Nature. 1961; 192: 535-541.
Rossi F, Zotti M. Biochemical aspects of phagocytosis in polymorphonuclear leucocytes. NADH and NADPH oxidation by the granules of resting and phagocytizing cells. Experientia. 1964; 20: 21-24.
Paul B, Sbarra AJ. The role of the phagocyte in host-parasite interactions. 13. The direct quantitative estimation of H2O2 in phagocytizing cells. Biochimica Biophysica Acta. 1968; 156(1): 168-78.
Klebanoff SJ. Myeloperoxidase-halide-hydrogen peroxide antibacterial system. Journal of Bacteriology. 1968; 95(6): 2131-8.
Rossi F, Romeo D, Patriarca P. Mechanism of phagocytosis-associated oxidative metabolism in polymorphonuclear leucocytes and macrophages. Journal of Reticuloendothelium Society. 1972; 12(2): 127-49.
Myers MA, McPhail LC, Snyderman R. Redistribution of protein kinase C activity in human monocytes: correlation with activation of the respiratory burst. Journal of Immunology. 1985; 135(5): 3411-6.NADPH oxydase
Myeloperoxydase
Cathcart MK. Regulation of superoxide anion production by NADPH oxidase in monocytes/macrophages: contributions to atherosclerosis. Arteriosclerosis Thrombosis and Vascular Biology. 2004; 24(1): 23-8. Review.
Babior BM. NADPH oxidase. Current Opinion in Immunology. 2004; 16: 42-7. Review.
Takeya R, Sumimoto H. Molecular mechanism for activation of superoxide-producing NADPH oxidases. Molecules and Cells. 2003; 16: 271-277.
Chisolm GM 3rd, Hazen SL, Fox PL, Cathcart MK. The oxidation of lipoproteins by monocytes-macrophages. Biochemical and biological mechanisms. Journal of Biological Chemistry. 1999; 274(37): 25959-62. Review.
Ghibaudi E, Laurenti E. Unraveling the catalytic mechanism of lactoperoxidase and myeloperoxidase. European Journal of Biochemistry. 2003; 270(22): 4403-12. Review.NO synthases
Nitric oxide : principles and actions. J Lancaster, ed., Academic Press, New York, London, Toronto, 1996, 355 pages.
Schmidt HHHW, Hofmann H, Schindler U, Shutenko ZS, Cunningham DD, Feelisc M. No •NO from NO synthase. Proceedings of the National Academy of Sciences USA. 1996; 93: 4492–14497.
Sagami I, Sato Y, Noguchi T. Miyajima M, Rozhkova E, Daff S, Shimizu T. Electron transfer in nitric-oxide synthase. Coordination Chemistry Review. 2002; 226: 179-186.
Craig DH, Chapman SK, Daff S. Calmodulin activates electron transfer through neuronal NO synthase reductase domain by releasing an NADPH-dependent conformational lock. Journal of Biological Chemistry. 2002; 277: 33987-33994.
Noguchi T, Sagami I. Daff S, Shimizu T. Important role of tetrahydrobiopterin in NO complex formation and interdomain electron transfer in neuronal nitric oxide synthase. Biochemical Biophysical Research Communications. 2001; 282: 1092-1097.
Li D. Stuehr DJ, Yeh SR, Rousseau DL. Heme distortion modulated by ligand-protein interactions in inducible nitric-oxide synthase. Journal of Biological Chemistry. 2004; 279: 26489-26499.
Marchal S,. Gorren ACF, Sorlie M, Andersson KK, Mayer B, Lange R. Evidence of two distinct oxygen complexes of reduced endothelial nitric oxide synthase. Journal of Biological Chemistry. 2004; 279: 19824-19831.PGsynthase
Deby C, Deby-Dupont G. Mechanisms of PGH synthase-1 (COX-1) activity and role of radical states. In : The Eicosanoids, P. Curtis-Prior, ed., John Wiley and Sons, 2004, pp.29-42.Lipoxygénases
Nelson MJ, Seitz SP. The structure and function of lipoxygenase. Current Opinion in Structural Biology. 1994; 4: 878-884.
Gaffney BJ. Lipoxygenases: structural principles and spectroscopy. Annual Review of Biophysical and Biomolecular Structures. 1996; 25: 431-459.
Gillmor SA, Villasenor A, Fletterick R, Sigal E, Browner MF. The structure of mammalian 15-lipoxygenase reveals similarity to the lipases and the determinants of substrate specificity. Nature Structural Biology. 1997; 4(12): 1003-9.Xanthine oxydo-réductase
McManaman JL, Bain DL. Structural and conformational analysis of the oxidase to dehydrogenase conversion of xanthine oxidoreductase. Journal of Biological Chemistry. 2002; 277(24): 21261-8.
Wright RM, Ginger LA, Kosila N, Elkins ND, Essary B, McManaman JL, Repine JE. Mononuclear phagocyte xanthine oxidoreductase contributes to cytokine-induced acute lung injury. American Journal of Respiratory Cell Molecular Biology. 2004; 30(4): 479-490.
Kuwabara T. Nishino K. Okamoto T. Matsumura B, Eger T, Pai EF, Nishino T. Unique amino acids cluster for switching from the dehydrogenase to oxidase form of xanthine oxidoreductase. Proceedings of the National Academy of Sciences USA. 2003; 100(14): 8170-8175.
Berry CE, Hare JM. Xanthine oxidoreductase and cardiovascular disease: molecular mechanisms and pathophysiological implications. Journal of Physiology. 2004; 555(3): 589-606.Activité peroxydasique de l'hémoglobine
Ortiz de Montellano PR. Catalytic sites of hemoprotein peroxidases. Annual Review of Pharmacology and Toxicology. 1992; 32: 89-107. Review.