 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD) Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
Remarques préalables :
1. Plus un radical est spécifique (ne réagit qu'avec un nombre limité d'espèces chimiques), plus sa durée d'existence sera longue (c'est une lapalissade, mais qui ne saute pas directement aux yeux des débutants). Ce radical peut alors atteindre des points relativement éloignés de son lieu de formation.
2. Le sigle ROS (Reactive Oxygen Species) concerne toutes les espèces oxygénées réactionnelles. Le sigle RNOS (Reactive Nitrated Oxygen Species) ne concerne que les espèces oxygénées activées azotées. Le sigle RNS (Reactive Nitrogen Species) est, à notre avis, erroné, car tous les RNS (comme NO•, NO2•, ONOO-, etc.) contiennent de l'oxygène: il doit être rejeté.
1. Produits de la réduction mono-électronique de l'oxygène
L'origine principale des formes oxygénées activées (ROS) réside dans la réduction d'O2 électron par électron. Cette cascade de réactions peut exister :
a) au niveau de la chaîne respiratoire mitochondriale, dans des circonstances pathologiques qui seront exposées dans le tome II de l'Initiation, l'Oxygène en pathologie des mammifères, annoncé dans l'introduction et qui doit paraître sur ce site.b) au cours de l'activité des diverses oxydases (description des plus importantes oxydases dans le chapitre XIII), selon le mécanisme général décrit précédemment (chapitre VI),
c) durant certaines intoxications (par certains médicaments et par le paraquat, par exemple) qui seront décrites dans l'Oxygène en pathologie des mammifères.
La fig. VII-1 montre comment sont générées deux formes activées importantes de l'oxygène : l'anion superoxye et son dérivé immédiat, le peroxyde d'hydrogène (l'eau oxygénée de l'ancienne pharmacopée).
Fig. VII-1 : Les étapes successives de la réduction de l'oxygène in vivo comportent une étape thermodynamiquement interdite (flèche rouge) qui ne peut être effectuée qu'en présence d'un catalyseur (enzyme du type oxydase).
a. Propriétés de l'anion superoxyde
En 1931, Haber et Willstätter proposèrent l'existence fugace d'espèces oxygénées telles que l'anion superoxyde :
1. Formation in vivo par catalyse enzymatique du franchissement de la première étape de réduction de l'oxygène.
Les principales enzymes génératrices de l'anion superoxyde, chez les mammifères, sont décrites dans le chapitre XIII.
2. Dismutation :
En milieu aqueux, aux pH biologiques, l'anion superoxyde a une durée d'existence très courte, car il subit, dans ces conditions, un processus de dismutation. Ce mécanisme est exposé de façon très élémentaire sur la fig. VII-2. La réalité chimique est nettement plus compliquée.
Thermodynamiquement, la réaction directe O2• + O2• est endothermique et ne peut donc pas être spontanée. Ceci permet d'expliquer la durée de vie relativement longue de l'anion superoxyde en milieux aprotiques (sans H+) et une possibilité d'accumulation dans les membranes (fig. VII-5). Mais pour simplifier, nous admettrons qu'il s'agit de la transformation rapide de O2• en H2O2 et en oxygène fondamental.

Fig. VII-2 : Dismutation de l'anion superoxyde.
3. Plus grande stabilité d'O2• dans les milieux aprotiques (absence de protons H+)
Voir fig. VII-5.
4. Nucléophilie (attraction par les noyaux)
O2• est un "arracheur" (ou accepteur) de protons H+, mais il peut aussi réagir au niveau des liaisons esters (fig. VII-3a).
O2• lyse notamment les esters d'acides gras (désestérification des phospholipides membranaires) (fig. VII-3b.).
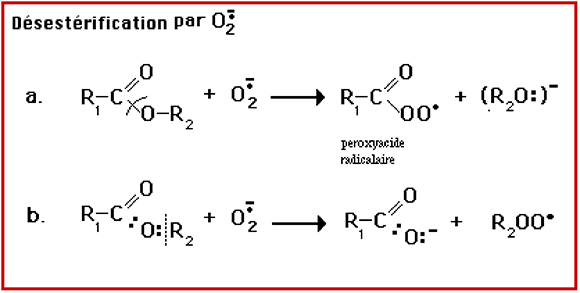
Fig. VII-3 : Une réaction nucléophile de l'anion superoxyde sur un ester d'acide gras,
avec formation d'un radical peroxyle ROO•. Elle ne se passe qu'en milieu non
protoné (dans l'espace délimité par les deux feuillets d'une double membrane cellulaire, par exemple).

Fig. VII-4: Rappel sur les phospholipides constitutifs des membranes cellulaires.
Importance de la désestérification des membranes : c'est le début d'une déstabilisation qui peut conduire à la lyse cellulaire.
Note sur la pénétration des membranes phospholipidiques par O2• : l'anion superoxyde peut traverser ces membranes puisqu'il est polarisé (Gus'kova et al., 1984). Néanmoins, si le pH s'abaisse (phagosomes des phagocytes), une partie d'O2• devient HO2• selon l'équation :O2• + H+ <-------> HO2• (pKa = 4,8)
HO2• est desestérifiant comme O2• (fig. VII-5).
Fig. VII-5 : Pour simplifier, les protéines transmembranaires et les esters de cholestérol n'ont pas été représentés. L'anion superoxyde protoné peut s'accumuler dans la zone hydrophobe et désestérifier les phospholipides, avec perte de la semi-perméabilité de la membrane. Là également pourait être généré du peroxynitrite (voir plus bas).
5. Réducteur efficace. L'anion superoxyde occupe une place suffisamment négative dans l'échelle des potentiels d'oxydo-réduction pour se comporter comme un réducteur efficace vis-à- vis d'une série de molécules et de cations métalliques. En biologie, les propriétés réductrices de l'anion superoxyde s'affirment particulièrement dans le métabolisme du fer : cet élément est stocké dans les cellules au sein de protéines spécifiques, les ferritines, qui ne le conservent qu'à l'état oxydé Fe3+. La réduction du métal provoque sa libération. Divers agents chimiques réduisent le fer, dont O2• :
![]() (1)
(1)
Dans les schémas proposés par les partisans des réactions de Fenton, c'est la capacité réductrice exercée sur le Fe3+ par l'anion superoxyde qui assure la continuité de ce mécanisme (par ailleurs contesté : voir ci-dessous, au point b.1. et chapitre IX). Cette propriété est à la base d'un des dosages les plus répandus de l'anion superoxyde (réduction du ferricytochrome c), mais son existence in vivo est controversée.
6. Oxydant faible. En milieu acide (pH < 5), O2• capte un proton H+, devenant HO2•, nettement oxydant. HO2• est probablement à l'origine de la légende de O2•, puissant oxydant. Mais de tels pH sont difficilement atteints dans les cellules, sauf peut-être dans les phagosomes.

7. Précurseur de H2O2 et du peroxynitrite ONOO-
Voir ci-dessous et au point 2.b.b. Propriétés du peroxyde d'hydrogène et de ses dérivés
1. Stabilité relative. Faut-il le rappeler ? H2O2 n'est pas une espèce radicalaire, mais une espèce activée de l'oxygène (ROS : Reactive Oxygen Species).
En l'absence de peroxydases ou de métaux de transition, H2O2 est une molécule relativement stable.Un mythe : la réaction d'Haber-Weiss :
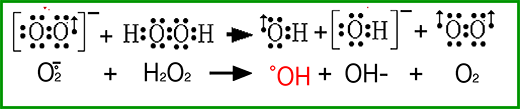
Fig. VII-6 : La génération d'une espèce radicalaire très agressive, le radical hydroxyle •OH, fut attribuée à la réaction du peroxyde d'hydrogène avec l'anion superoxyde. Cette équation est formulée dans nombre d'articles médicaux et pharmacologiques. Or, des arguments péremptoires de cinétique chimique et de thermodynamique ont réduit à néant cette réaction. Mais comme l'a dit ironiquement Koppenol (2000), cette fiction réapparaît régulièrement dans la littérature et il est probable que dans une dizaine d'années, on "redécouvrira", par manque d'information de base, la réaction d'Haber-Weiss. 2. H2O2, précurseur de diverses formes activées de l'oxygène
a) Le radical hydroxyle.
Fig. VII-7 : Produits de la radiolyse de l'eau en présence d'oxygène.Exception faite de la radiolyse de l'eau (fig. VII-7) par exposition à des radiations très énergétiques (rayons X ou γ), les radicaux •OH ne se forment que durant de très courtes périodes (nanosecondes ?), car ils réagissent et disparaissent sur le lieu même de leur formation. Outre l'exposition aux radiations ionisantes, deux autres systèmes peuvent générer ces fantômes dans les milieux biologiques : la décomposition du peroxynitrite (voir ci-dessous) et les radicaux oxo-ferryles (chapitre VIII et chapitre IX).
b) Dérivés halogénés : rôle de la myéloperoxydase : voir chapitre XIII.
2. Les oxydes d'azote et le radical carbonyle
Les radicaux libres ne sont plus seulement considérés comme des agents pathogènes, mais aussi comme des facteurs physiologiques intervenant dans la signalisation et l'homéostasie cellulaire.
De nombreux chercheurs considèrent que, outre le NO•, le radical carbonyle CO3• et le dioxyde d'azote NO2• sont impliqués dans le fonctionnement normal des cellules. Certains ajoutent à cette liste le peroxynitrite. On distingue fréquemment les ROS (symbole désignant toutes les espèces oxygénées activées non azotées) et les RNOS (espèces oxygénées et azotées).
Le lecteur est invité à recueillir de plus amples données en lisant le magistral travail d'Augusto, publié en 2002.a. monoxyde d'azote NO•
Ce gaz est connu depuis bien longtemps, mais sa grande importance biologique n'a été révélée que depuis les travaux d'Ignarro et de ses collaborateurs qui ont découvert en 1979 son rôle vaso-dilatateur. Simultanément, d'autres physiologistes avaient mis en évidence un nouveau facteur relâchant les cellules musculaires lisses du manchon vasculaire, qu'ils baptisèrent EDRF ("endothelium-derived relaxing factor"). En 1986, Ignarro proposa que l’EDRF serait le NO• ou un nitroso-précurseur labile, ce qui fut prouvé chimiquement en 1987. La vasodilatation est loin d'être le seul effet physiologique dû au NO•.
Le NO• est produit par les NO• synthases (NOS) qui constituent une famille d'enzymes hémiques présentes dans de nombreux types cellulaires (l'endothélium vasculaire, les monocytes, les granulocytes, les hépatocytes, etc.).
Les NOS sont activées par la fixation de la calmoduline-Ca2+. Elles sont étudiées avec plus de détails dans le chapitre XIII de cette monographie.
Fig. VII-8 : Bilan de la synthèse biologique du NO• : un acide aminé essentiel, l'arginine, est oxydé par une
demi-molécule d'oxygène, l'autre formant une molécule de NO• : la NO synthase se range parmi les monooxygénases.
Propriétés du NO•
Le monoxyde d'azote ("nitric oxide" en anglais) est un gaz paramagnétique présentant un électron célibataire.
C'est un radical libre.
Les traités de chimie minérale considèrent que le monoxyde d'azote est stable aux températures biologiques. Effectivement, il peut être stocké sans problème comme l'azote ou l'hydrogène, mais à l'abri de l'oxygène. Il est loin d'être inerte ! Il présente un doublet d'électrons (le couple de points rouges) et peut former des liaisons de coordination avec les métaux de transition, avec le fer de l'hémoglobine par exemple (équation 2 où la flèche fine symbolise une liaison dative).
(2)
Et surtout, il réagit très rapidement avec les doublets et les triplets.
Ainsi, il ne peut pas coexister avec l'oxygène (fig. VII-9 ) car il réagit selon la réaction :
(3)
Fig. VII-9 : Mise en évidence de la réaction NO•/O2.
De même, il forme un composé très instable et endothermique, le peroxynitrite, par réaction avec l'anion superoxyde (doublet).
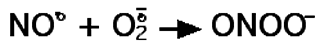 (4)
(4)
Des propriétés physiques remarquables :
a. Un coefficient de diffusion (à 37°C) dans l'eau plus élevé que ceux de l'oxygène, du CO2 et du CO.
b. Les membranes lui sont perméables.
De ces propriétés, il découle que la propagation du NO• depuis son lieu d'apparition est rapide. Il possède les qualités d'un messager de courte durée de vie dont l'effet s'arrête très rapidement dès que la source qui l'émet cesse de fonctionner.Le peroxynitrite était connu depuis quelques décennies par les spécialistes de chimie minérale lorsqu'en 1990, Beckmann et son équipe publièrent des résultats expérimentaux laissant supposer que cette molécule pouvait se former in vivo au cours de la réaction représentée ci-dessus (réaction 4).
1) La formation in vivo de ONOO- était considérée en 2002 "as a solid evidence " (Augusto et al. 2002), bien que des doutes récents aient été émis.
Elle a donné un regain d'importance à la SOD puisque celle-ci diminue considérablement la durée d'existence de O2• et par là, les chances de rencontre des partenaires de l'équation (4).2) Voie de décomposition : L'effet-cage, maintenant NO2• et •OH dans une cage due à une organisation des molécules d'eau, a été proposé par Pryor dès 1994 et a suscité de nombreuses controverses qui ne se sont point calmées.
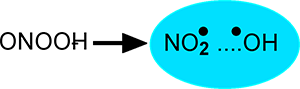
Fig. VII-10 : Effet-cage proposé par Pryor (1995).
La voie de décroissance de ONOO- est l'isomérisation en nitrate :
![]() (5)
(5)
3) Rôle du CO2 : modulation de la réaction de ONOO- avec les molécules organiques.
Depuis les travaux de Lymar et coll. et de Pryor et coll.(1996), on sait que les actions biologiques du peroxynitrite sont influencées par la présence de CO2. Or, il est bien connu que le dioxyde de carbone existe à des concentrations élevées dans les compartiments extra- et intracellulaires. Le CO2 module principalement les réactions de nitration provoquées par ONOO-. Il est admis aujourd'hui qu'il se forme un adduit ONOOCO2-, le nitrosoperoxycarbonate.
En l'absence d'un substrat adéquat (une molécule aromatique comme la tyrosine, par exemple), l'adduit se décompose en nitrate et CO2. Sinon, il se forme du NO2• et un radical anionique CO3• (l'anion carbonyle) dans la proportion d'un tiers.
Le système (NO2• + CO3•) réalise des nitrations mono-électroniques des composés aromatiques (Bonini et coll., 1999).c. Dioxyde d'azote NO2•
Ce composé a intéressé les biologistes bien avant le NO• car il constitue une fraction importante des polluants atmosphériques des villes. Mais l'étude de ses propriétés autres que toxicologiques n'a commencé que depuis quelques années, bien après l'engouement pour NO•.
Il est probable que NO2• puisse se former in vivo, par réaction avec l'oxygène dissous près des sites de formation de NO•, selon l'équation:
(6)
En milieux biologiques, où la concentration en NO• est faible, le NO2• formé a moins de chance de dimériser selon l'équation (VII-7), ce qui lui ferait perdre l'état radicalaire :
(7)
Il est peu soluble dans l'eau alors que son dimère l'est 100 fois plus, celui-ci se transformant en nitrite et nitrate
(8)
Cependant, aux faibles concentrations, de l'ordre de celles attendues en milieux biologiques, le monomère NO2• serait la forme prédominante. NO2• agit comme un radical oxydant, mais son potentiel d'électrode (0,99 V) se situe en dessous de celui de l'anion carbonyle (1,78 V) et du radical hydroxyle (2,3 V). NO2• réagit avec O2• pour former du peroxynitrate, un composé nitré qui suscite de plus en plus d'intérêt chez les spécialistes, mais sur lequel nous ne pouvons nous étendre pour ne pas déséquilibrer cette introduction limitée :
(9)
Réactions avec les acides gras
De nombreux travaux sont en cours, depuis quelques années, qui démontrent une réactivité importante de NO2• avec les acides gras non saturés et particulièrement avec l'acide arachidonique dont les formes nitrées constitueraient de nouveaux messagers biologiques. Les précurseurs dans ce domaine furent Pryor et son équipe, dès 1983. L'attaque se fait au niveau des doubles liaisons d'acide gras tels que les acides linoléique, linolénique et arachidonique. Le NO2• peut donner un composé d'addition (acide gras nitré) après création préalable d'un radical, par transfert d'électron par exemple.
Fig. VII-11 : Nitration d'un acide gras par NO2•Mais il peut transformer l'acide gras biologique cis en sa forme trans biologiquement inactive. Par exemple, l'acide arachidonique, un acide gras comportant 20 carbones et 4 doubles liaisons, est transformé en eicosanoïdes (prostaglandines, leucotriènes, thromboxanes, etc), messagers intra- et extracellulaires indispensables. La formation d'eicosanoïdes ne s'effectue que lorsque l'acide gras précurseur est sous forme cis.
Réactions diverses
Dans toutes, il y a création d'un radical libre.
a. Réaction d'addition telle que la réaction de la fig. VII-11, au niveau des doubles liaisons d'une molécule.
b. Enlèvement d'un hydrogène H•, créant un radical libre :
(10)
c. Transfert d'électron :
![]() (11)
(11)
Accumulation de NO2• dans les espaces intramembranaires
Comme dans le cas de l'anion superoxyde (fig. VII-5), le dioxyde d'azote peut exister plus longtemps dans les milieux aprotiques des membranes.
d. Anion carbonyle CO3•
L'anion carbonyle provient théoriquement de l'oxydation de l'anion carbonate CO3= :
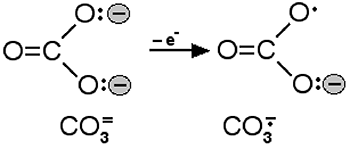
Fig. VII-12 : Formation de l'anion carbonyle.
L'étude du radical carbonyle est associée étroitement à celle de composés oxonitrés. La présence de CO2 au cours des réactions du peroxynitrite modifie le cours des réactions, les nitrations étant favorisées par rapport aux hydroxylations. Cet effet de CO2 a été expliqué par la formation de ONOOCO2-, le nitrosoperoxycarbonate.
Génération in vivo :
La formation de l'ion radicalaire CO3• est difficile in vivo, car peu d'agents sont suffisamment oxydants pour réaliser cette réaction.
Celle-ci peut cependant se produire :
1. par radiolyse
2. par le peroxynitrite.
Diverses équations de formation du radical carbonyle ont été proposées, telles celles de Lyman et Hurst (1996) :
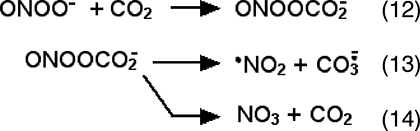
Le radical carbonyle a été détecté par RPE dans des systèmes d'origine biologique.
Une autre voie peut être l'isomérisation du nitrosoperoxycarbonate en nitrocarbonate dont les voies de décomposition sont différentes :
(15 )
En milieu aqueux, le nitrocarbonate décroît selon l'équation :
(16)
Citons aussi l'effet-cage mentionné plus haut dans ce chapitre (Fig. VII-10), qui peut libérer le radical •OH, lequel réagirait avec une molécule de carbonate acide (bicarbonate) en formant l'ion carbonyle.
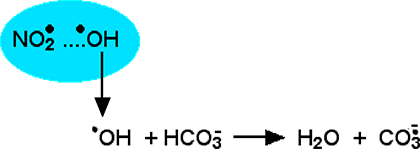
Fig. VII-13 : Libération du radical hydroxyle et réaction avec le carbonate acide.
Propriétés chimiques du radical carbonyle :
Ce radical est considéré comme acide fort (pKa < 0) : il arrache des électrons dans les molécules avoisinantes. Il présente un potentiel rédox de 1,17 V, donc intermédiaire entre celui de NO2• (+ 0,99 V) et celui de •OH (2,3V). C'est donc un puissant oxydant. Il oxyde aisément le glutathion ionisé :
![]() (17)
(17)
3. Radicaux ferryles
Il s'agit de formes oxydées du fer qui sont de plus en plus proposées pour jouer le rôle des radicaux •OH (fig. VI-7). La seule certitude d'existence de ces derniers vaut pour les milieux aqueux exposés aux radiations ionisantes. L'importante question de l'alternative "ferryl" versus •OH est traitée dans le chapitre VIII.
4. Oxydes lipidiques radicalaires et alkoxyles
La peroxydation lipidique est certes à l'origine de maints processus générant des formes radicalaires de l'oxygène qui sont agressives pour les constituants cellulaires. Ces questions sont traitées au chapitre X.
5. Bibliographie
Propriétés de l'anion superoxyde
Fee JA, Valentine JS. Chemical and physical properties of superoxide. In : Superoxide and superoxide dismutases, Michelson AM, Mc Cord JM, Fridovich I, eds, Acad Press 1977, pp. 19-57.Bielski BHJ, Cabelli DE. Superoxide and hydroxyl radical chemistry in aqueous solution. In : Active oxygen in chemistry, Foote CS, Valentine JS, Greenberg A, Liebman JL, eds, Blackie Academic & Professional, London, New York, 1995, pp.66-104.
Niehaus WG Jr. A proposed role of superoxide anion as a biological nucleophile in the deesterification of phospholipids. Bioorganic Chemistry. 1978; 7,: 7-84.
Deby C, Goutier R. New perspectives on the biochemistry of superoxide anion and the efficiency of superoxide dismutases. Biochemical Pharmacology. 1990; 39: 399-405. Review
Gus'kova RA, Ivanov II, Kol'tover VK, Akhobadze VV, Rubin AB. Permeability of bilayer lipid membranes for superoxide (O2•) radicals. Biochimica Biophysica Acta. 1984; 19; 778 :579-85
Mythe de Haber-Weiss
Koppenol WH. The Haber-Weiss cycle--70 years later. Redox Reports. 2001; 6: 229-34. Review.Propriétés du monoxyde d'azote
Ignarro JL. Nitric oxide as a communication signal in vascular and neuronal cells. In : Nitric oxide, Lancaster L Jr, ed., Academic Press, New York London, 1996, pp.111-137.Beckman J.S. The physiological and pathological chemistry of nitric oxide. In : Nitric oxide, Lancaster L Jr, ed., Academic Press, New York London, pp.1-82.
Peroxynitrite
Beckman JS, Beckman TW, Chen J, Marshall PA, Freeman BA. Apparent hydroxyl radical production by peroxynitrite : implications for endothelial injury from nitric oxide and superoxide. Proceedings of the National Academy of Sciences USA, 1990; 87: 1620-1624.Pryor WA, Squadrito GL. The chemistry of peroxynitrite: a product from the reaction of nitric oxide with superoxide. American Journal of Physiology. 1995; 268: L699-722. Review.
Squadrito GL, Pryor WA. The formation of peroxynitrite in vivo from nitric oxide and superoxide. Chemistry Biology Interactions, 1995 ; 96: 203-6. Review
Lymar SV, Jiang Q, Hurst JK. Mechanism of carbon dioxide-catalyzed oxidation of tyrosine by peroxynitrite. Biochemistry. 1996; 35: 7855-7861.
Pryor WA, Lemercier JN, Zhang H, Uppu RM, Squadrito GL. The catalytic role of carbon dioxide in the decomposition of peroxynitrite. Free Radical in Biology and Medicine 1997; 23: 331-8.
Bonini MG, Radi R, Ferrer-Sueta G, Da AM, Ferreira C, Augusto O. Direct EPR detection of the carbonate radical anion produced from peroxynitrite and carbon dioxide. Journal of Biological Chemistry. 1999; 274: 10802-10806.
Jourd'heuil D, Miranda KM, Kim SM, Espey MG, Vodovotz Y, Laroux S, Mai CT, Miles AM, Grisham MB, Wink DA. The oxidative and nitrosative chemistry of the nitric oxide/superoxide reaction in the presence of bicarbonate. Archives of Biochemistry and Biophysics. 1999; 365: 92-100.
Dioxyde d'azote
Nitration des acides gras
Balazy M, Poff CD. Biological nitration of arachidonic acid. Current Vascular Pharmacology. 2004; 2; 81-93. Review.Lima ES, Di Mascio P, Abdalla DS. Cholesteryl nitrolinoleate, a nitrated lipid present in human blood plasma and lipoproteins. Journal of Lipid Research. 2003; 44: 1660-1666.
Balazy M, Iesaki T, Park JL, Jiang H, Kaminski PM, Wolin MS. Vicinal nitrohydroxyeicosatrienoic acids: vasodilator lipids formed by reaction of nitrogen dioxide with arachidonic acid. Journal of Pharmacology and Experimental Therapeutic. 2001; 299: 611-619.
Anion carbonyle
Meli R, Nauser T, Latal P, Koppenol WH. Reaction of peroxynitrite with carbon dioxide: intermediates and determination of the yield of CO3• and NO2•. Journal of Biological and Inorganic Chemistry. 2002; 7: 31-6.Tien M, Berlett BS, Levine RL, Chock PB, Stadtman ER. Peroxynitrite-mediated modification of proteins at physiological carbon dioxide concentration: pH dependence of carbonyl formation, tyrosine nitration, and methionine oxidation. Proceedings of the National Academy of Sciences USA,. 1999; 96: 7809-14.
Augusto O, Bonini MG, Amanso AM, Linares E, Santos CC, De Menezes SL. Nitrogen dioxide and carbonate radical anion: two emerging radicals in biology. Free Radical in Biology and Medicine, 2002; 32: 841-859. Review.