 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie : tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie : tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
Chapitre XIV: Toxicité des espèces activées de l'oxygène (ROS: Reactive Oxygen Species)
1. L'apparente toxicité de l'oxygène
Une apparente toxicité de l'oxygène a été observée par les découvreurs de cet élément, Priestley, Scheele et Lavoisier (entre 1775 et 1782), puis, cent ans plus tard, étudiée systématiquement par Paul Bert (1878). Cet aspect négatif de l'oxygène sera ensuite totalement négligé pendant trois quarts de siècle, pour être redécouvert après la deuxième guerre mondiale par les radiobiologistes. Nous avons vu que les radiations ionisantes exercent un effet délétère qui est considérablement augmenté dans les organismes irradiés sous oxygène pur : c'est l'effet oxygène. Ce phénomène est encore appliqué à la radiosensibilisation des tumeurs en réalisant une hyperoxygénation locale.L'hyperoxie démontre-t-elle une toxicité directe de l'oxygène ?
De nombreux travaux ont montré que l'inhalation d'oxygène pur, même à pression normale (hyperoxie normobare), est fatale pour les rongeurs si elle est poursuivie pendant plus de 60 heures.
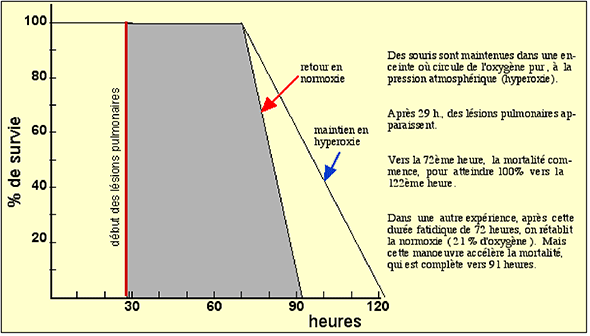
Fig. XIV-1 : Courbe de mortalité de souris maintenues en hyperoxie (100% O2)
On observe des troubles dont la gravité croît avec la durée d'exposition lorsqu'on élève la concentration de O2 dans l'air inspiré (hyperoxie). La fig. XIV-1 schématise l'expérience.
C'est l'intégrité du poumon qui est mise en cause dans ces expériences. Après une latence de plus de 24 heures, des lésions apparaissent dans le parenchyme pulmonaire. Lorsque commence la mortalité, le mal est irréversible : le retour en normoxie accélère les processus létaux.
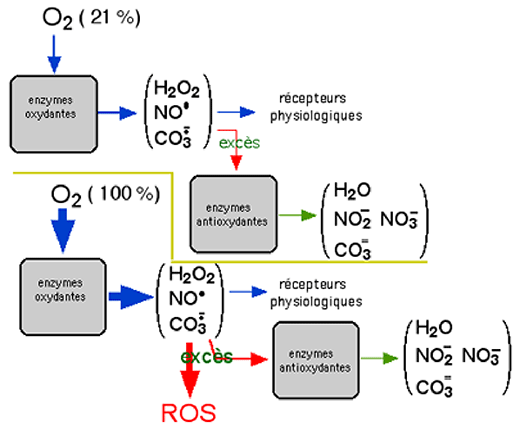
On a pensé avoir démontré ainsi que l'oxygène lui-même est moins inactif que ne l'affirment les physicochimistes et qu'il peut être directement toxique. La fig. XIV-2 montre qu'il n'en n'est rien et que c'est l'équilibre des enzymes pro- et antioxydantes qui est en jeu (voir chapitre IV). Si en général, l'augmentation du substrat augmente la production d'une substance générée par une enzyme, on sait que des enzymes antioxydantes, telles que la catalase, sont inactivées lorsque la concentration en H2O2 augmente.
Une toxicité indirecte de l'oxygène est invoquée au cours d'une série de phénomènes pathologiques (anoxie-réoxygénation, poumon de choc, fibroplasie rétrolentale des prématurés, athérosclérose, etc …). Ces pathologies feront l'objet d'études détaillées dans le tome II de cet ouvrage (L'oxygène en pathologie des mammifères), consacré aux aspects pathologiques du métabolisme de l'oxygène.
Nous avons vu (chapitre V) que l'oxygène est un facteur d'entretien des réactions radicalaires, notion mise à profit par les radiothérapeutes (effet oxygène).

2. Les vrais coupables
a) les ROS d'origine interne
Ce sont les diverses espèces oxygénées activées (ROS: Reactive Oxygen Species) qui valent à l'oxygène la réputation d'être toxique. Toutes ne sont pas à l'état radicalaire.
Nous avons étudié les principaux ROS dans les chapitres précédents :
- le peroxynitrite ONOO- (chapitre VII);
- les ions ferryles (chapitre VIII et chapitre IX);
- HClO et les chloramines (chapitre XIII);
- l'oxygène singulet (chapitre XI);
- les peroxydes lipidiques (chapitre X, point 3 ) et leurs produits de décomposition, les aldéhydes (chapitre X, point 5).
Les ROS manifestent leur toxicité lorsqu'ils dépassent les possibilités de défense cellulaires décrites au chapitre XV.1. Danger d'un dépassement quantitatif par excitation excessive des enzymes pro-oxydantes, décrites au chapitre XIII, dont certaines cellules sont porteuses. C'est l'allégorie du pompier pyromane.
L'étude de ces excès de fonctionnement et de leurs causes sera exposée dans le tome consacré aux aspects pathologiques du métabolisme de l'oxygène (L'oxygène en pathologie des mammifères). Mais nous rappellerons ici le rôle joué par certaines bactéries endocellulaires (Chlamydia, Mycoplasma) dont certaines protéines (HSP60) déclenchent, chez les monocytes, les cascades inflammatoires les transformant en macrophages s'attaquant aux tissus où nichent les bactéries (voir chapitre XIII, figure XIII-3).
Des libérations brutales d'hémoglobine (administration parentérale d'hémoglobine libre, crises hémolytiques) peuvent submerger les moyens de contrôle, tels que celui exercé par les hème oxygénases (chapitre XV).2. Les métaux de transition peuvent saturer les protéines de transport ou les possibilités de stockage par excès pathologique de résorption du métal (hémochromatoses, porphyries, intoxication aiguë par le fer ou le cuivre), avec les conséquences attendues (formation d'ions ferryles, etc …). La lecture du chapitre IX aidera le lecteur à comprendre ces problèmes.
4. Complicité de l'oxygène dans l'entretien des réactions radicalaires. Lors de la production de lipoperoxydes par les lipoxygénases ou la PGsynthase, des radicaux lipidiques sont générés. Un cycle de peroxydation entretenu par la présence d'O2 (chapitre X, figure X-4) est toujours possible.
5. L'ischémie-reperfusion. Le rôle des mitochondries dans la genèse des ROS et des protéines nitrées sera examiné dans le tome consacré à L'oxygène en pathologie des mammifères .
6. Cibles des ROS
Le rôle agressif des espèces oxygénées, des peroxydes lipidiques, de leurs dérivés aldéhydiques et des hèmes libres (hémoglobine libérée par hémolyse, par exemple) est bien démontré. Ces espèces activées, généralement radicalaires, s'attaquent aux membranes phospholipidiques, aux protéines et au DNA. Jusqu'aux travaux de Beckman et coll. (1990), les mécanismes invoqués pour expliquer les lésions tissulaires d'origine oxydative mettaient en jeu le fer (Haber-Weiss, Fenton, etc … : voir chapitre IX). Ces théories étaient insuffisantes pour rendre compte de tous les phénomènes, notamment de l'effet protecteur des superoxyde dismutases (SOD) qui ne font paradoxalement qu'accélérer la formation d'un partenaire essentiel de la réaction de Fenton. La disparition de l'anion superoxyde, oxydant faible, n'explique pas l'effet parfois spectaculaire des SOD. Beckman et al. imaginèrent que O2• devait réagir avec le monoxyde d'azote NO• pour former le peroxynitrite ONOO- (chapitre VII)b) Les ROs d'origine médicamenteuse
1. La ménadione
La ménadione est une quinone qui est le précurseur biologique de la vitamine K. Elle peut provoquer des phénomènes hémolytiques (lyse des globules rouges) plus ou moins graves, surtout chez les personnes déficientes en G-6-PD (glucose-6-phosphate déshydrogénase). La ménadione peut déclencher des crises d'anémie hémolytique de gravité proportionnelle à l'insuffisance génétique. Ce phénomène est partiellement inhibé par les coumarines.
Le mécanisme de l'attaque de l'hémoglobine globulaire est représenté sur la fig. XIV-3.
Fig. XIV-3 : En présence d'hémoglobine vacante (non vectrice d'O2 comme il s'en trouve dans
les hématies du sang veineux), la ménadione peut capter un électron du Fe2+ en formant de la méthémoglobine.
Nous avons vu au chapitre XIII que la méthémoglobine subit une autoxydation en présence d'oxygène et produit H2O2 (chapitre XIII, fig. XIII-22). D'autre part, la semi-quinone formée est elle-même réductrice d'O2 en redevenant la ménadione. L'anion superoxyde résultant de cette réaction, en dismutant en H2O2, contribue à son tour à générer de la méthémoglobine. Le fait paradoxal, dans ce dernier mécanisme, est l'aggravation de la méthémoglobinisation sous l'effet de la SOD (superoxyde-dismutase). L'enzyme protectrice est la catalase. Nous avons affaire à un phénomène toxique auto-entretenu.
La ménadione peut être réduite en semi-quinone par d'autres mécanismes que celui impliquant Hb-Fe2+. Ainsi, le traitement de cultures de cellules endothéliales par la ménadione produit O2• dans les secondes qui suivent, puis des radicaux lipidiques détectables par RPE ainsi que la présence d'H2O2 dans le milieu extra-cellulaire.2. Quelques autres exemples
Divers antibiotiques sont producteurs de radicaux libres très réactionnels, tels que l'adriamycine (Myers et al, 1977), la bléomycine, la doxorubicine (Gewirtz, 1999) et le chloramphénicol.
Les dérivés du nitrofuranne peuvent également intervenir dans un cycle de réduction d'O2.c) Facteurs oxydants de la pollution du milieu
1) L'ozone a été étudiée au chapitre XI.
2) Le NO2 a fait l'objet d'un long paragraphe dans le chapitre VII.
3) Le paraquat est un exemple très intéressant de pollution insidieuse et mortelle par herbicide.
Le paraquat est le méthylviologène des électrochimistes (1,1-diméthyl-4,4'-bipyridinium dichlorure). Il fut longtemps utilisé comme herbicide, mais son usage a été interdit à la suite de décès d'agriculteurs qui l'avaient employé en pulvérisation. On constata qu'il est très toxique pour les mammifères, produisant de graves lésions dans les alvéoles pulmonaires (fibrose interstitielle progressive), mais altèrant aussi les reins, les surrénales, le foie et le cerveau. L'intoxication est lente et continue après l'arrêt de l'absorption du produit, car il se régénère dans les tissus. Les sols traités restent longtemps pollués où le toxique se régénère de la même manière.
La fig. XIV-4 représente le schéma généralement admis pour expliquer l'effet toxique du paraquat: celui-ci passe aisément à un état radicalaire dont la stabilité est entretenue par la délocalisation de l'électron célibataire au sein d'une structure pyridinique. D'autre part, la molécule est régénérée par cession de cet électron à une molécule d'oxygène, produisant ainsi l'anion superoxyde.
3. Bibliographie
Beckman JS, Beckman TW, Chen J, Marshall PA, Freeman BA. Apparent hydroxyl radical production by peroxynitrite: implications for endothelial injury from nitric oxide and superoxide. Proceedings of the National Academic of Sciences USA. 1990; 87(4): 1620-4.
Goldberg B, Stern A. Production of superoxide anion during the oxidation of hemoglobin by menadione. Biochimica Biophysica Acta. 1976; 437: 628-32.
Goldberg B, Stern A. Superoxide anion as a mediator of drug-induced oxidative hemolysis. Journal of Biological Chemistry. 1976; 251: 6468-70.
Myers CE, McGurie WP, Liss RH et al. Adriamycin: the role of lipid peroxidation in cardiac toxicity and tumor response. Science. 1977; 197: 165-167.
Gewirtz DA. A critical evaluation of the mechanisms of action proposed for the antitumor effects of the anthracycline antibiotics adriamycin and daunorubicin. Biochemical Pharmacology. 1999; 57: 727-41. Review.Fisher HK, Clements JA, Wright RR. Enhancement of oxygen toxicity by the herbicide paraquat. American Review of Respiratory Disease. 1973; 107: 246-52.
Bus JS, Aust SD, Gibson JE. Paraquat toxicity: proposed mechanism of action involving lipid peroxidation. Environmental Health Perspectives. 1976; 16: 139-46.
Frank L. Prolonged survival after paraquat. Role of the lung antioxidant enzyme systems. Biochemical Pharmacology. 1981; 30: 2319-24.
Goldstein S, Samuni A, Aronovitch Y, Godinger D, Russo A, Mitchell JB. Kinetics of paraquat and copper reactions with nitroxides: the effects of nitroxides on the aerobic and anoxic toxicity of paraquat. Chemical Research Toxicology. 2002; 15: 686-691.
Niemczyk E, Majczak A, Hallmann A, Kedzior J, Wozniak M, Wakabayashi T. A possible involvement of plasma membrane NAD(P)H oxidase in the switch mechanism of the cell death mode from apoptosis to necrosis in menadione-induced cell injury. Acta Biochimica Polonica. 2004; 51: 1015-1022.