 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
Chapitre XI: Formes particulières de O2

Fig. XI-1: Aurore boréale.
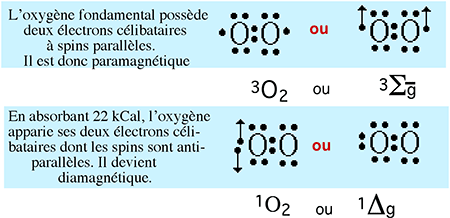
| Fig. XI-2 : Comparaison entre la structure électronique de l'oxygène fondamental (celui que nous respirons), qualifié de triplet de par sa conformation biradicalaire (d'où le 3 en exposant de précession : 3O2), et celle de l'oxygène à électrons uniformément appariés ou oxygène singulet (d'où le 1 en exposant : 1O2). |
Il faut fournir 22 kcal (énergie élevée rarement fournie par les réactions biochimiques) à l'oxygène "ordinaire" pour le transformer en singulet.
Comme il est montré au chapitre VI, fig. VI-7, l'oxygène singulet n'est plus biradicalaire, car ses deux électrons libres sont appariés. Dès lors, cette forme d'O2, échappant à la règle d'interdiction de spin, devient très réactionnelle, vis-à-vis notamment des structures non saturées abondantes dans les membranes, et constitue un puissant initiateur de cycles de peroxydations. 1O2 est très instable. Il peut apparaître durant les cycles de peroxydation lipidique, amplifiant ainsi les processus d'autoxydation. Il se forme probablement au cours de l'attaque de l'eau oxygénée par la myéloperoxydase, durant la phagocytose (voir chapitre XIII), mais son origine la plus fréquente semble être la voie photochimique; divers sensibilisateurs, tels que l'hypéricine du millepertuis, l'huile de bergamote ou les porphyrines libérées durant les diverses formes de porphyries, produisent de l'oxygène singulet au niveau de la peau exposée à la lumière visible, avec les conséquences cellulaires découlant de la peroxydation lipidique.

Fig. XI-3 : Formation de l'oxygène singulet par action d'un photosensibilisateur.
2. L'ozone
a) Propriétés et modes de formation
Dès le 19ième siècle, les électriciens qui purent réaliser des étincelles électriques remarquèrent une odeur spéciale, alliacée, qui provenait des engins (bobine de Rumhkorff par ex.) qui produisaient ces étincelles. Le chimiste Schonbein découvrit qu'il s'agissait d'une forme allotropique de l'oxygène qu'il baptisa ozone, du grec οζειν (sentir). Soret établit la structure de cet oxygène puant qui est formé de 3 atomes. La formation d'ozone exige un apport important d'énergie fourni par les ultra-violets ou les étincelles électriques (réaction endothermique).
L'ozone est faiblement paramagnétique; c'est un puissant agent d'oxydation, ayant un potentiel standard de + 2,07 volts (Weast, 1977)
O3 + 2 H+ + 2 e- <====> O2 + H2O
O3 réagit énergiquement avec nombre de composés organiques et inorganiques (nitrites, amines, nitriles, alcanes, alcènes, etc …) à température ordinaire (Atkinson et Carter, 1984; Pryor et al., 1982). Ce gaz réagit par attaque électrophilique avec les composés sulfhydrilés. Il forme des sulfoxydes et des sulfones avec la méthionine (Bailey, 1982) et de l'acide sulfonique avec les disulfures. O3 attaque également les composés aromatiques (Yamamoto, 1979).
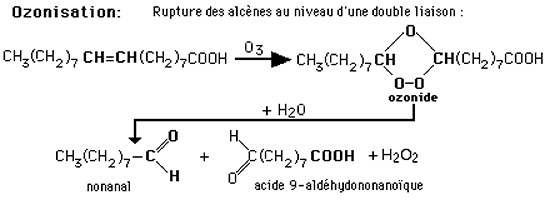
avec formation de deux aldéhydes + 1 H2O2 (en présence d'H20).
Fig. XI-4 : Caractère instable des ozonides en milieu aqueux.
Devenir des ozonides:
Extrêmement instables, ils se décomposent à température ordinaire en couple d'aldéhydes, en générant du peroxyde d'hydrogène.
Formation de l'ozone dans la nature
L'ozone est normalement présent dans la basse atmosphère, durant le jour, à la concentration de 0,04 ppm. Cette concentration s'élève de manière indésirable dans les régions industrialisées où sa principale origine se trouve dans un processus photochimique impliquant les rayons UV d'une part et les oxydes d'azote (pollution industrielle) ainsi que les hydrocarbures (essence non brûlée par les moteurs d'automobiles) d'autre part. Observée d'abord à Los Angeles (dans le "smog"), la pollution à l'ozone a été constatée dans un nombre croissant de grandes villes industrielles des USA, puis en Europe.Mécanismes de formation:
Dans la biosphère, l'ozone se forme au cours des réactions dues à la présence simultanée de pollutions par les oxydes d'azote et les vapeurs d'essence incomplètement brûlées et d'irradiation ultra-violette d'origine solaire:
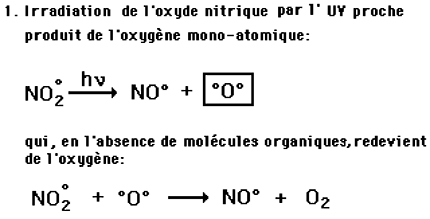
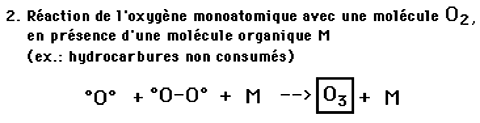
Fig. XI-5 : Formation de l'ozone.
b) Effets biochimiques
L'ozone agit:
a) comme oxydant des chaînes lipidiques,
b) comme générateur de peroxyde d'hydrogène et, par cette voie, d'espèces oxygénées activées et de radicaux libres,
c) comme précurseur d'aldéhydes.
Des concentrations supérieures à 0,15 ppm produisent des changements biochimiques notables, tant pulmonaires qu'extra-pulmonaires (Goldstein, 1979).
La mort peut survenir par œdème pulmonaire (LD50 : 25-40 ppm/heure : concentration multipliée par le temps d'exposition) (Goldstein et coll.,1973). Un phénomène d'adaptation humaine à l'ozone est bien reconnu : l'exposition aux doses sub-létales entraîne une tolérance progressive, s'expliquant par la biosynthèse de systèmes enzymatiques protecteurs (Hackney et coll., 1977).1. Oxydation des chaînes lipidiques
Des signaux radicalaires furent observés, dès 1967, durant l'ozonisation de l'acide linoléique (Goldstein et coll., 1968; Pryor et coll., 1976), les lipoperoxydes formés pouvant se décomposer, par réaction avec l'ozone, en radicaux libres:ROOH + O3 ----------> ROO• + •OH + O2
(Mustafa, 1990)Au cours de cette ozonolyse des chaînes grasses, il se produit un "zwitterion" (ion possédant à la fois une charge positive et une charge négative), lui-même capable d'induire des peroxydations lipidiques (Roehm et coll., 1971)
2. Lipoperoxydations pulmonaires induites par l'ozone (Fletcher et Tappel, 1973)
On a mis en évidence des diènes conjugués dans les tissus pulmonaires de rats exposés à 0,4 ppm pendant 4 heures et 0,7 ppm pendant 5-7 jours.
3. Bibliographie
Oxygène singulet
Foote CS, Clennan EL. Properties and reactions of singlet dioxygen. In : Active oxygen in chemistry. Foote CS, Valentine JS, Greenberg A, Liebman JL, eds, Blackie Academic & Professional, London, New York, 1995, pp.104-140.Ozone
Propriétés générales
Consulter: Michel A, Bénard J. Chimie minérale, Masson & Cie, ed. Paris, 1964, pp.499-502.
Cram DJ. Hammond GS. Chimie Organique, Gauthier-Villars, Paris, 1968.
Roberts JD, Caserio MC. Chimie organique moderne, Ediscience, Paris, 1968.
Leh F. Ozone. Properties, toxicity, and applications. Journal of Chemical Education. 1973; 50: 404-5.Bailey PA. Ozonation in Organic Chemistry, vol.II. Nonolefinic ompounds. In : Organic Chemistry. Blomquist AT, Wassermann HH, eds, New York, Academic Press,1982.
Criegee R. The course of ozonisation of unsaturated compounds. Recent Chemical Progress. 1957; 18: 111-120.
Fletcher BL, Tappel AL. Protective effects of dietary alphatocopherol in rats exosed to toxic levels of ozone and nitrogen dioxide. Environmental Research. 1973; 6: 165-175.
Goldstein BD. The pulmonary and extra-pulmonary effects of ozone. In: Oxygen Free radicals and tissue damages. Ciba Foundation Symposium Excerpta Medica, Amsterdam, Oxford, New York, 1979, 65: pp.295-319.
Goldstein BD, Lai LY, Ross SR, Cuzzi-Spada R. Susceptibility of inbred mouse strain to ozone. Archives of Environmental Health,; 1973; 27: 412-413.
Hackney JD, Linn WS, Karuza SK, Buckley RD, Law DC, Bates DV, Hazucha M, Pengelly LD, Silvermann F. Effects of ozone exposure in Canadians and Southern Californians. Evidence for adaptation. Archives of Environmental Health. 1977; 32: 110-116.
Mustafa G. Biochemical basis of ozone toxicity. Free Radicals in Biology and.Medicine. 1990; 9: 245-65.
Pryor WA, Prier DG, Church DF. Radical production from the interaction of ozone and PUFA as demonstrated by electron spin resonance spin-trapping techniques. Environmental Research. 1981; 24: 42-52.
PryorWA, Dooley MM, Church DF. Mechanisms for the reactions of ozone with biological molecules: the source of the toxic effects of ozone. In: Proceedings of the International Symposium on the Biomedical Effects of Ozone and related Photochemical Oxidants. Lee SD, Mustafa MG, Mehlman MA, eds. Princeton, NJ, Princeton Scientific Publication, Advances in Modern Toxicology. 1982; vol.V.
Pryor WA, Stanley JP, Blair E, Cullen BG. Autoxidation of polyunsaturated fatty acids. Part 1. Effcct of ozone on the autoxidation of neat methyl linoleate and methyl linolenate. Archives of Environmental Health. 1976; 31: 201-210.
Roehm JN, Hadley JG, Menzel DB. Oxidation of unsaturated fatty acids by ozone and nitrogen dioxide. A common mechanism of action. Archives of Environmental Health. 1971; 23: 142-148.
Weast RC. Handbook of Chemistry and Physics. 57th Ed. Boca Raton, FA, CRC Press, 1977; p. D-194.
Yamamoto Y, Niki E, Shiokawa H, Kamiya Y. Ozonation of organic compounds. 2. Ozonation in water. Journal of Organic Chemistry. 1979; 44: 2137-2142.
Goldstein BD, Balchum OJ, Demopoulos HB, Duke PS. Electron paramagnetic resonance spectroscopy. Free radical signals associated with ozonization of linoleic acid. Archives of Environmental Health. 1968; 17: 46-9.