 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Initiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
Chapitre XV: Défense contre l'oxydation incontrôlée
Comme nous l'avons vu au chapitre IV, un flux continu d'électrons assume, dans la mitochondrie, une production incessante d'énergie permettant à l'être vivant de croître, de réparer continuellement ses structures et de lutter contre les agents létaux. Ce transfert continu d'énergie exige une longue gamme de couples redox, maintenus dans une série de compartiments successifs dont l'environnement redox croît progressivement (devient donc plus oxydant). Le départ de la cascade d'électrons se fait dans une zone très réductrice (potentiel redox très négatif) vers le point d'aboutissement qui est généralement l'oxygène chez les Eucaryotes (dont l'Homme !). Le cytosol est également le siège de transferts d'électrons. Nous avons vu (chapitre XIII) que des substances oxygénées très réactionnelles et très oxydantes (ROS) pouvaient se produire durant des circonstances pathologiques ou accidentelles. Non seulement les ROS peuvent léser gravement des organelles de première importance et le DNA, mais aussi changer les équilibres de l'environnement redox, paralysant la signalisation et inhibant la production d'énergie. En un demi-siècle, les conceptions de protection contre l'oxydation incontrôlée ont profondément varié.
1. Stabilisateurs de l'environnement redox
a. Systèmes d'enzymes
1. Système GSH peroxydase séléniée/GSSG réductase
NB: Pour les propriétés du glutathion, voir chapitre IV
Ces peroxydases s'attaquent non seulement au peroxyde d'hydrogène, mais également aux peroxydes organiques (lipoperoxydes).
En 1957, G.C. Mills découvrait, dans les érythrocytes de rat, une des principales enzymes utilisées par les cellules des mammifères pour lutter contre l'excès d'H2O21. Auparavant, Keilin and Hartree2 avaient observé que l'oxydation de l'hémoglobine en methémoglobine par H2O2, au sein de l'hématie, n'était pas inhibée par la catalase. Mills démontra que le glutathion (GSH) associé à certaines protéines inhibait complètement cette oxydation. Il s'agissait d'un système enzymatique non inhibé par KCN, donc de nature non hémique comme le sont les peroxydases classiques1. Il fallut attendre 1968 pour découvrir la présence de sélénium dans la GSH peroxydase3. Ce sont Flohé and Schlegel (1971) qui ont mis en évidence les deux enzymes dans la matrice des mitochondries4.
Cette peroxydase est qualifiée aujourd'hui de séléno-enzyme. Outre les globules rouges, de nombreux types cellulaires l'abritent et notamment les monocytes qui sont de gros producteurs d'H2O2 et courent un risque certain d'autoxydation. C'est une protéine tétramérique dont chaque unité contient une sélénocystéine :
Le rôle de la GSH peroxydase (GSHPx) apparaît de plus en plus important :
a) elle est répandue dans un grand nombre de types cellulaires;
b) elle s'attaque non seulement à H2O2, mais aussi aux autres hydroperoxydes, y compris les hydroperoxydes lipidiques sauf les peroxydes des acides gras constitutifs des phospholipides5,6.
Ces considérations permettent d'écrire l'équation générale:
En détaillant la réaction, on constate qu'il y a formation de 2 radicaux thiyles GS• :
Les radicaux dimérisent pour former un disulfure GSSG :
La détoxification des phospholipides peroxydés est assumée par la combinaison de l'activité de la phospholipase A2 et la réduction des peroxydes d'acides gras libérés par la GSHPx . Brigelius-Flohé et coll. (1994) ont décrit une séléno-enzyme réduisant les phospholipides peroxydés en dérivés hydroxy inoffensifs6.
Les GSH peroxydases non séléniées (NS GPx) : Dès 1978, Burk et coll.7 avaient découvert que la GSH peroxydase séléniée (GSH Px) n'était pas la seule enzyme capable de "détoxiquer" les lipoperoxydes . Dans les carences en sélénium, des enzymes utilisant le GSH comme co-facteur peuvent remplacer, mais de manière insuffisante, la GSHPx8.
Interdépendance enzymatique : Le fonctionnement des GSH peroxydases exige nombre de molécules de glutathion réduit. Il se produit une accumulation de disulfure GS-SG. La GSH réductase réduit les disulfures GSSG et reconstitue le stock de GSH9,10.
Comme pour la NADPH oxydase, on peut associer les mécanismes (fig. XV-1):
R peut être une chaîne carbonée (ROOH : lipoperoxyde) ou un atome d'hydrogène (H2O2 : peroxyde d'hydrogène) (d'après la référence10).
B : Régénération du GSH par la GSH réductase.2. Système des thiorédoxines
Fig. XV-2 : La thiorédoxine (Trx), donneuse d'atomes H, réduit diverses enzymes dithiolées.
Son activité s'arrêterait rapidement sans l'intervention d'une Trx-réductase séléniée, Trx-réduc.Dans l'exemple de la fig. XV-2, une thiorédoxine (Trx) réduit les ponts disulfures -S-S- d'une enzyme dithiolée oxydée EnzS2. Les Trxs sont considérées comme des protéines donneuses universelles d'atomes d'hydrogène H•, en présence de thiorédoxines réductases. L'oxydation des ponts disulfures dans une enzyme modifie considérablement sa structure et son activité enzymatique.
Les thioredoxines (Trx) sont de petites protéines de 12kDa, présentant un site actif dithiolé11,12, qui font partie d'une système antioxydant dont les premiers membres connus sont le glutathion (GSH) et la glutathion peroxydase. Les thiorédoxines sont des enzymes à activité antioxydante intrinsèque comme toutes les protéines à groupement thiol (-SH)13,14. Elles protègent aussi la cellule contre les agents élecrophiles12. La forme oxydée des Trxs est réduite par les thiorédoxine réductases. Les Trx sont aussi des donneurs d'électrons pour des enzymes porteuses de deux fonctions thiols pouvant former un pont disulfure telles que les peroxyrédoxines15.Thiorédoxine réductases (TrxR)
Les thiorédoxine réductases sont des enzymes homodimériques à FAD, plus lourdes que les Trx (54-58 kDa). Elles renferment des sélénocystéines16.
Fig. XV-3 : Site actif de la sélénocystéine. Sec: résidu de la sélénocystéine.
Par cette particularité, les TrxRs présentent de grandes analogies avec la GSH peroxydase qui possède le même site actif en position terminale C. La forme oxydée de la TrxR est constituée par un pont mixte entre la cystéine et la sélénocystéine.
3. Glutathion-S-transférases (GST)
Les glutathion transférases (EC.2.5.1.18) catalysent des réactions nucléophiles du GSH avec des composés apolaires contenant un atome électrophile : carbone, azote ou soufre. Ces enzymes sont des agents de détoxification ; leurs substrats sont divers, mais nous ne citerons dans le cadre de cette étude que les carbonyles insaturés en α ou β, notamment les aldéhydes provenant de la décomposition des lipoperoxydes. Les GST mitochondriales constituent une famille comprenant de nombreux isoformes, induits par les stress oxydants.
Fig. XV-4 : Conjugaison du 4-hydroxynonénal, dérivé très toxique d'hydroperoxydes d'acides polyèniques, en présence d'une GSH-S-transférase. 4. Les hèmes oxygénases
Ces enzymes existent principalement dans les cellules endothéliales où elles traitent l'hémoglobine provenant de la rupture des hématies. En présence de cytochrome P450 réductase, de NADPH et d'oxygène, elles fonctionnent comme des monooxygénases scindant la molécule d'oxygène dont un atome se fixe sur le macrocycle, l'autre devenant de l'eau. Cet hème intermédiaire sera oxydé à son tour avec rupture du macrocycle et libération d'une molécule de CO. Une nouvelle molécule d'oxygène sera utilisée en présence de NADPH pour ouvrir le cycle et libérer le fer : il se forme la biliverdine qui sera à son tour réduite en bilirubine17,18.
Fig. XV-5 : A gauche : l'hème de l'hémoglobine avec l'indication du lieu de rupture du macrocycle par l'hème-oxygénase.
A droite : les produits de la lyse libérant du FeIII, de la biliverdine et du CO.b. Enzymes spécifiques
Ce sont des métallo-enzymes (dans le cytosol : SOD à cuivre et à zinc; dans les mitochondries : SOD à manganèse).
Nous avons déjà vu au chapitre IX leur mécanisme d'action. Elles accélèrent considérablement la vitesse de dismutation de O2• en H2O2.
En langage plus profane, 10 milliards de molécules par molécule-gramme d'O2• dismutent par seconde en présence de SOD et seulement 10 millions en l'absence du catalyseur : la vitesse de disparition est multipliée par 1000 par la SOD cupro-zincique. Il est évident que les SOD accélèrent la formation de H2O2 et facilitent la genèse des ROS qui découlent de ce composé. Mais c'est une défense contre les desestérifications membranaires et contre la formation de peroxynitrite.
2. Catalase
La catalase, contrairement aux autres peroxydases, ne produit pas de radicaux libres. Elle régit l'équation :
2 H2O2 ==> 2 H2O + O2
La catalase est présente dans les peroxysomes des tissus à métabolisme élevé : foie, coeur, rein, rate, poumons ("alveolar cells type II"), ainsi que dans les cellules endothéliales de l'artère pulmonaire.
Fig. XV-6 : Cycle rédox de la catalase.
La catalase présente un "turnover" parmi les plus élevés des enzymes connues (40.000.000 molécules par seconde)19,20.
c. Les systèmes antioxydants coopératifs
Les exemples sont nombreux de coopérations entre systèmes enzymatiques et molécules et atomes actifs dans l'équilibre rédox.
La fig. XV-7 nous donne un exemple de telles associations fonctionnelles.
Fig. XV-7 : Coopération antioxydante dans le plasma. L'albumine est vectrice de fer.
Pour le passage sur la transferrine, il faut une oxydation préalable du métal qui est effectuée grâce à la céruloplasmine21.d. Une illustration importante de la défense anti-ROS enzymatique : les hématies
Un risque permanent d'autoxydation de l'hémoglobine existe dans l'hématie. Le danger existe surtout dans la microcirculation (réseau capillaire) où la pression d'O2 est relativement basse, entraînant une certaine insaturation de l'hémoglobine qui devient "high-spin" (chapitre IX). On estime à 3% la quantité d'hémoglobine qui subit des processus d'autoxydation en 24 heures, produisant ainsi de l'anion superoxyde qui dismute en H2O2, entretenant une concentration permanente de 2.10-10M en peroxyde d'hydrogène. Ces mécanismes potentiellement générateurs de ROS sont équilibrés par les enzymes antioxydantes de l'hématie, principalement le couple SOD/catalase et par la GSH peroxydase. Les lipoperoxydes provenant de l'oxydation des lipides par la methémoglobine sont également traités par la GSH peroxydase22,23,24,25.
Fig. XV-8 : Autoxydation de l'hémoglobine.
En rouge : voies menant aux ROS. En bleu : réactions enzymatiques de détoxification.En perdant sa molécule d'oxygène, l'hème de l'Hb devient paramagnétique. Lors du retour de O2, le risque est grand d'une formation de methémoglobine (FeIII) et d'anion superoxyde. Mais la SOD intervient, puis la catalase. La methémoglobine est attaquée par une macroxyprotéinase qui la transforme en produits inoffensifs. Les molécules d'H2O2 ayant échappé à la catalase peuvent oxyder la metHbFeIII restante en oxo-ferryl (chapitre XIII) et peroxyder les molécules lipidiques LH (chapitre X). Les peroxydes formés LOOH sont alors traités par la GSH-peroxydase, ce qui élimine un risque de toxicité.
Il s'agit de petites molécules agissant de deux manières fondamentalement différentes : soit anticatalytique, en inhibant les enzymes productrices de ROS décrites au chapitre XIII, soit stœchiométrique, en réagissant directement, molécule contre molécule, avec les molécules oxydantes ; celles-ci sont neutralisées, mais les molécules antioxydantes perdent leur propriété (à moins d'un système biologique de régénération).
Nous examinerons d'abord les antioxydants stœchiométriques qui furent les premiers utilisés dans la lutte contre les ROS.1) Découverte du phénomène " anti-oxygène"
L'effet anti-oxygène est une notion chimique qui est toujours d'actualité. C. Moureu et C. Dufraisse26 ont observé, dans les années 1920, que des traces d'hydroquinone empêchent la polymérisation de l'acroléine, processus radicalaire se produisant en présence d'oxygène. Ce fut le départ de la théorie des antioxygènes. Le terme "antioxygène" fut assez promptement remplacé par l'expression d'origine anglo-saxonne "antioxydant".
Fig. XV-9 : Paris 1923. A gauche, Charles Moureu, père du concept d'antioxygène.
A droite, Charles Dufraisse qui découvrira, en 1930, le rôle catalyseur des métaux dans la peroxydation lipidique.2) L'industrie huilière et les antioxydants
Les chimistes des huiles non saturées démontrèrent, peu après la seconde guerre mondiale, que le rancissement des huiles non saturées, dont le mécanisme impliquant une peroxydation avait été éclairci au début des années quarante, pouvait être évité par l'incorporation de molécules du type phénolique, à raison d'une molécule d'antioxydant pour 6000 molécules lipidiques. Des miliers de molécules "antioxydantes" furent ainsi proposées. Soulignons dès maintenant que la protection se faisait en milieu homogène et fermé (exemple: une bouteille d'un litre d'huile de tournesol ).3) Extrapolation aux systèmes vivants
La compréhension des mécanismes de rancissement des graisses et des huiles ainsi que les progrès de la radiobiologie, science qui démarra après les drames d'Hiroshima et de Nagasaki, secouèrent l'imagination d'un certain nombre de biologistes qui virent dans les peroxydations, et surtout dans l'existence de radicaux libres, l'origine de nombre de nos maux et particulièrement du pire de ceux-ci : le vieillissement. C'est dès 1956 que le chef de file de ces nouveaux docteurs Faust se signala : Denham Harman publiait sa première communication dans The Journal of Gerontology27, assignant un rôle actif aux radicaux libres dans le vieillissement; puis, il administra oralement des antioxydants utilisés en industrie à des souris et proclama que ces substances prolongeaient leur existence en piégeant (scavenging) les radicaux libres, êtres funestes encore niés à l'époque par bien des biochimistes.
Harman fit de nombreux disciples groupant moultes sectes médicales qui sont aujourd'hui en plein exercice de leur sacerdoce.4) Manière de voir les antioxydants stœchiométriques aujourd'hui
Ce sont des molécules de petite taille, souvent porteuses de fonctions phénoliques, qui réagissent mole à mole avec les radicaux à éliminer. Pour neutraliser la production de ROS par les enzymes pro-oxydantes, l'organisme doit en faire une forte consommation. Il faut aussi que la molécule antioxydante réponde à diverses conditions pour être vraiment efficace :
a. vitesse de réaction avec le ROS beaucoup plus élevée que celle de ce ROS avec la molécule à protéger.
On a calculé le coefficient de vitesse de la réaction de l'acide salicylique avec des radicaux •OH par radiolyse pulsée.
kOH = 2.1010 molécules par mole par seconde.
Pour nombre d'aminoacides aliphatiques (alanine par ex.):
kOH = 108 molécules par mole par seconde
On voit que l'acide salicylique réagit 100 fois plus vite avec le ROS •OH que l'aminoacide : l'acide salicylique protège l'alanine de l'oxydation ; c'est donc un antioxydant efficace.
b. solubilité : il est évident que l'antioxydant protègera mal une substance soluble dans l'eau et non dans les graisses, s'il est lui-même peu soluble dans l'eau et soluble dans les lipides. C'est le cas du tocophérol qui protège surtout contre les lipoperoxydes et les radicaux alkoxyles.
c. potentiel rédox du couple molécule à protéger/antioxydant dans les conditions de pH imposées: des antioxydants comme l'acide urique ou même le tocophérol peuvent jouer un rôle oxydant dans certaines circonstances.
Dès 1930, le pharmacien C. Dufraisse, qui déjà avait proposé le terme antioxygène pour désigner ces composés ralentissant ou inhibant l'autoxydation des lipides, montrait qu'un même antioxygène, selon les conditions expérimentales, pouvait se comporter comme un pro-oxygène28. De nombreuses publications très récentes sont venues confirmer ce fait en apparence paradoxal.5) Domaines d'utilisation des "scavengers"
Lors de leur découverte, les antioxydants stœchiométriques connurent un énorme succès. Comme protecteurs de milieux autoxydables, graisses alimentaires, lard, huiles non saturées (maïs, tournesol, etc.), on trouva, entre les deux guerres, des milliers de molécules antioxydantes.
Ces inhibiteurs stœchiométriques sont efficaces quand il s'agit de protéger un système fermé où des molécules s'autoxydent très lentement. On est surpris de la lenteur d'apparition de peroxydes dans des huiles réputées très peroxydables telles que le linoléate d'éthyle, même sous "bubbling" d'O2. Mais lorsque la peroxydation devient détectable, après parfois des semaines, elle s'accélère de manière exponentielle. Une molarité faible de molécules protectrices [butylhydroxytoluène (BHT), butylhydroxyanisole (BHA), sorbate, etc ...] réduisent efficacement les formes oxydantes qui naissent épisodiquement dans le milieu peroxydable. Dans les conditions statiques de conservation, en système fermé, on admet qu'un antioxydant efficace (comme le gallate de propyle : fig. XV-10 A) protège dans la proportion d'une molécule pour 6000.
La notion d'antioxydant a lontemps appartenu à la chimie alimentaire et industrielle.Une telle stratégie de protection a été transposée dans le vivant
Les antioxydants stœchiométriques qui sont efficaces en systèmes fermés le sont bien moins en milieu vivant où interviennent les enzymes prooxydantes qui produisent des milliers de ROS à la seconde.
Les concentrations de ces "piègeurs" doivent être élevées. Ils conviennent bien comme radioprotecteurs, si la cause de formation est de très courte durée. S'il s'agit de neutraliser des radicaux se formant de manière ininterrompue pendant une certaine durée (activation des macrophages par les cytokines, par ex.), il est clair que leur efficacité sera faible ou nulle.6) Principaux antioxydants stœchiométriques utilisés chez l'animal et l'homme
La plupart des antioxydants utilisés en médecine et dans l'industrie alimentaire sont des phénols ou des polyphénols. Un exemple type de polyphénol est celui du gallate de propyle, fort utilisé dans l'industrie (fig. XV-10 A). Les polyphénols "neutralisent " des molécules radicalaires réactionnelles en devenant eux-mêmes des radicaux relativement stables, peu réactionnels.
Parmi les antioxydants naturels figurent les tocophérols dont on connaît 4 isomères (fig. XV-10 A et B): α, β, γ, δ, d'activité antioxydante variable. On les dénomme globalement vitamine E. C'est l'α-tocophérol qui est le plus utilisé en pharmacopée. Les tocophérols sont oxydés par les radicaux libres en devenant eux-mêmes des radicaux tocophéryles. Il est toujours admis que les radicaux tocophéryles sont régénérés par l'acide ascorbique (fig. XV-11) et que, sans cette synergie, les tocophérols sont inactifs :1) TocoH + RO• ===> Toco• + ROH (RO• : radical alkoxyle, voir chapitre X)
2) Toco• + AscH- ===> TocoH + Asc•Des dérivés isopréniques des tocophérols (les tocotriénols) sont actuellement à l'étude (fig. XV-10 B).
Les tocophérols : molécules modèles démontrant la faiblesse du concept d'antioxydant
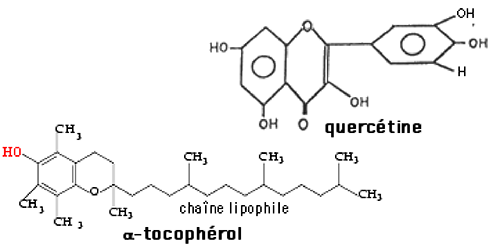
Fig. XV-10 A : A gauche, le gallate de propyle apparaît comme un triphénol. A droite, la quercétine, rangée en pharmacologie
parmi les flavonoïdes, est un polyphénol (structure polycyclique). En-dessous, la fonction OH est rouge
pour signaler que c'est sa présence qui confère au tocophérol son caractère rédox.
Fig. XV-10 B : A gauche, deux molécules voisines de l'α-tocophérol, le β-T, estimé peu actif comme antioxydant,
et le γ-T, molécule longtemps négligée dont l'étude a recommencé depuis peu.
7) Usage des antioxydants stœchiométriques en médecine et en biologie
L'attention des chercheurs a principalement été attirée sur le rôle que pourraient jouer les antioxydants dans la lipoperoxydation des lipoprotéines in vivo, phénomène initiateur des processus d'athérosclérose conduisant aux accidents cardio-vasculaires (AVC), toujours cause première de la mortalité humaine dans les pays développés.
Malgré la nécessité d'une forte consommation de telles substances pour assurer une bonne protection (et le problème de savoir si ces antioxydants pénétrent réellement dans les cellules n'est pas résolu), les idées primitives continuent, de par leur nature simpliste, à dominer les raisonnements chez beaucoup de médecins et biologistes. Trois substances sont préconisées : la vitamine E, la vitamine C et le carotène.
Un argument de poids fut apporté pour justifier l'usage du tocophérol : sa régénération par la vitamine C (Fig. XV-11).
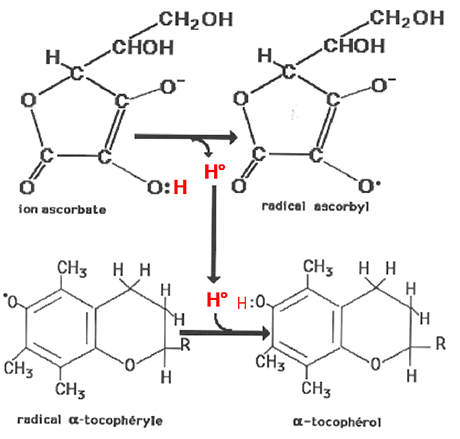
Fig. XV-11 : Régénération du tocophérol (vit. E) par l'acide ascorbique (vit. C).
Cet effet rénovateur de la vitamine C expliquerait la rapidité avec laquelle apparaissent les phénomènes de carence en acide ascorbique (scorbut) et la présence de concentrations millimolaires de cette vitamine dans les cellules à forte production de ROS (leucocytes neutrophiles).
Régénération de l'ascorbate
La vitamine C peut être régénérée tant à partir du radical ascorbyle que de l'acide déshydroascorbique (DHA) par des processus enzymatiques et non enzymatiques. Le radical ascorbyle est réduit par une semidéhydroascorbate réductase-NADH dépendante29 et par une sélénoenzyme, la NADPH-dépendante thiorédoxine réductase30. Le DHA peut être réduit en ascorbate de manière non enzymatique par le GSH ou l'acide lipoïque31 aussi bien que par la thiorédoxine réductase et la glutarédoxine, enzyme dépendante du GSH32.
Régulation par l'insuline de l'absorption de la vitamine C.
La captation cellulaire de la vitamine C est un processus actif insulino-dépendant33. L'implication complexe de la vitamine C a fait l'objet d'une mise au point récente34."French paradox" et régime méditerranéen
Il y a une vingtaine d'années, les statisticiens firent remarquer que la mortalité par AVC était significativement plus basse dans la partie méridionale de la France que dans le reste des pays développés.
Une étude récente établit que le nombre de décès par accident cardiaque sur 100.000 habitants est 1,4 fois plus élevé en Grande-Bretagne qu'en France pour les hommes et 1,6 fois pour les populations féminines ; si l'on compare les chiffres entre hommes et femmes du même pays, on obtient un rapport de 4,7 pour la France et de 3,18 pour l'UK35. Pourtant, les populations du Nord, anglo-saxonnes comme germaniques, suivaient plus docilement les injonctions médicales, remplaçaient le beurre par la margarine non saturée et préféraient souvent les alcools forts au vin rouge (des chirurgiens écossais n’avaient-ils pas recommandé le whisky à doses modérées comme élixir de longue vie ?). Ce sont ces austères nordiques qui parlèrent de french paradox. On pensa évidemment à imputer cet avantage gaulois au régime alimentaire et on arriva à la notion de régime méditerranéen, car on constata que l'on pouvait opposer le Nord et le Sud de l'Europe : la mortalité par AVC était trois fois plus élevée chez les Finlandais ou les habitants du Royaume-Uni qu'en Espagne ou au Portugal. Les différences alimentaires constatées portaient sur une plus grande richesse en produits végétaux, en fruits et en huile d'olive dans la consommation méridionale36,37.
Nous nous permettrons de rappeler ici que, dans la décennie 1970, des ligues cardiologiques du Nord avaient conseillé impérativement l'usage d'huiles non saturées (sources potentielles de lipoperoxydes !) comme moyen de lutter contre l'hypercholestérolémie, cause, pense-t-on encore, de l'athérosclérose. Mais finalement, l'hypercholestérolémie ne sembla pas être suffisamment différente chez les deux types de population pour expliquer la plus grande incidence d'accidents vasculaires chez les Nordiques35.8) Que penser de la protection anti-ROS non enzymatique en 2008 ?
Le "french paradox" a incité les chercheurs à étudier trois éléments-clés dans la neutralisation des peroxydes et des radicaux libres : la vitamine C, la vitamine E et le β-carotène.a. Résultats des enquêtes méta-analytiques
De nombreuses "méta-analyses" (analyses de données récoltées pendant plusieurs années et publiées par diverses équipes dans le monde sur un sujet médical) ont été réalisées depuis une dizaine d'années, portant sur des milliers de cas. Ce sont surtout les molécules les plus utilisées en médecine comme antioxydants qui ont fait l'objet de ces enquêtes, telles que la vitamine C, la vitamine E et le carotène.
Les enquêtes médicales contemporaines fournissent des résultats très divergents. Dès 1996, Duell38, se posant la question du rôle protecteur des suppléments antioxydants dans l'alimentation sur le risque athéroscléreux, reconnaît que cette pathologie repose bien sur l'oxydation de lipoprotéines, mais que l'effet bénéfique des antioxydants stœchiométriques n'est pas prouvé. Cependant, l'introduction dans l'alimentation de fruits et de légumes lui paraît avoir un effet favorable. Munday et coll.39 avaient publié en 1998 que l'apport alimentaire de tocophérols ou de BHT ne pouvait enrayer le développement des processus athéroscléreux chez la souris. Shaish et al. (1999)40 considèrent que, chez un modèle animal athérogène, le processus pathologique n'est pas amélioré par la combinaison de carotène et de vitamine E. En 2000, Asmis et Jelk confirment que la lésion athéroscléreuse de départ, la formation de cellules spumeuses (foam cells) à partir de macrophages humains, n'est pas enrayée par la présence dans le milieu de culture de vitamine E41. En 2004, Törnwall et al., évaluant les données d'une enquête de six ans sur les effets protecteurs du carotène et de la vitamine E sur l'évolution des maladies coronariennes chez 29.000 patients entre 50 et 69 ans, fumeurs, concluent à l'inutilité de ces suppléments42. Pham et Plakogiannis dénoncent en 2005 le manque d'effets protecteurs des suppléments alimentaires de tocophérols43. En 2006, Voutilainen et al., s'ils reconnaissent les effets favorables d'un régime enrichi en fruits et en légumes, ne reconnaissent aucun effet de l'apport de carotène seul44.
L'une des dernières études, menée pendant 15 ans en Hollande, affirme que ni les tocophérols ni la vitamine C ne modifient la mortalité cardiovasculaire, mais bien le carotène45; cette mortalité est essentiellement due à l'athérosclérose, toujours considérée unanimement comme une attaque de la paroi des artères par des processus oxydants, comme l'affirment Siekmeier et al. en 200746; ces mêmes auteurs passent en revue l'efficacité des tocophérols, constatant que les résultats obtenus in vitro sur des systèmes simples démontrent l'efficacité protectrice de la vitamine E, mais que ceux provenant d'enquêtes sur animaux et sur l'homme sont "plus conflictuels"46. Comme le résument Abudu et al. ( 2004)47, les essais cliniques montrent l'échec de la thérapie par vitamines antioxydantes. Déjà en 2002, Brown et coll. avaient drôlement posé la question : "les vitamines antioxydantes et la thérapie des lipopathies, est-ce la fin d'une longue romance"48. Que penser en 2008 de la prévention et du traitement des maladies cardiaques par les antioxydants classiques ? Thomson et ses collaborateurs restent très dubitatifs, spécialement à l'égard de la vitamine E49.b. Tentatives d'explication des échecs de la thérapeutique stoechiométrique : effets pro-oxydants
La vitamine C
Nous avons vu, au chapitre IV, la capacité de l'ascorbate à participer à une réaction d'oxydation, in vitro. Abudu et coll. n'ont pas manqué cette hypothèse47. L'ascorbate (vit C) manifeste des propriétés pro-oxydantes grâce à sa forme radicalaire, spécialement en présence de métaux de transition50,51. Le GSH, lui aussi, peut agir comme pro-oxydant en présence de métaux47.Propriétés pro-oxydantes de la vitamine E
L' α-tocophérol est impliqué dans les TMP ("tocopherol-mediated peroxidations"). Neuzil et al. (2001), passant en revue les travaux effectués sur cet agent, n'hésitent pas à écrire52 : « Des données récentes révèlent que les activités de la vitamine vont au-delà de sa fonction redox. Bien plus, il a été montré que la vitamine E exacerbe certains processus associés à l'athérogenèse ». La vitamine E est comme un être à double visage, Dr Jekyll et Mr Hyde, agissant selon les circonstances comme antioxydant ou comme oxydant50,53-58.Toxicité de la vitamine E
Beaucoup d'auteurs situent le seuil de toxicité au-dessus de 800 mg/jour et considèrent que de plus fortes quantités sont toxiques.
Dans un travail de compilation assez récent, Miller et al. (2005)58 ont publié une méta-analyse portant sur 136.000 participants de 19 groupes d'essais cliniques, chez lesquels une gamme de doses de vitamine E fut administrée allant de 16 à 2000 UI par jour, seule ou avec de l'ascorbate. A hautes doses, seule ou accompagnée, la vitamine E s'est avérée dangereuse, aggravant la mortalité. Le seuil de dangerosité est placé par Miller et al. à 400 UI par jour (1 UI = 0,66 mg). 264 mg/jour peuvent être nuisibles dans des traitements prolongés58.
Selon Siekmeier et al.46, la vitamine E exercerait (aux doses modérées) une action anti-athéroscléreuse, tandis que le β-carotène et l'ascorbate ne donneraient pas de résultats significatifs. Selon Miller et al. (2005), la vitamine E peut inhiber la glutathion-S-transférase cytosolique58.Un nouveau regard sur les tocophérols
Il apparaît de plus en plus sûr que l'α-tocophérol agit par une autre voie que celle de « l'antioxydation » et qu'il pourrait être considéré comme une molécule inhibant ou ralentissant les enzymes "pro-oxydantes "59,60.
Selon Azzi et coll. (2002), l'α-tocophérol possède des propriétés qui le distinguent de tous les autres tocophérols, y compris le Trolox et l'acétate de tocophérol61. Ces propriétés sont indépendantes des capacités antioxydantes et captrices de radicaux dont on pare généralement la vitamine E. L'α-tocophérol serait inhibiteur de la protéine C kinase (voir figure XIII-7), ralentirait la croissance anormale des fibres musculaires lisses (un des facteurs des lésions vasculaires) et inhiberait la transcription du gène de la collagénase.
Des protéines fixant spécifiquement l' α-tocophérol, les TAPs ("tocopherol-associated proteins"), ont été isolées62.Toxicité du carotène :
Lors d'une enquête portant sur près de 30.000 individus mâles, fumeurs, des placebos, de la vitamine E et du β-carotène furent administrés comme supplément d'alimentation pendant des périodes de 5 à 10 ans. Le β-carotène provoqua une augmentation du risque sans explication plausible; les résultats obtenus avec l'α-tocophérol ne plaident pas pour son usage chez les fumeurs42. Pour Voutilainen et al. (2006)44, le carotène n'est pas à recommander comme préventif de l'athérosclérose. Young et al. (2001)63 estiment que, si l'on peut démontrer in vitro les caractères pro- et anti-oxydants du β-carotène, seul l'effet antioxydant devrait se manifester in vivo; mais ces auteurs ne se préoccupent pas des grandes enquêtes cliniques.Il s'agit de molécules ou de systèmes assumant la prévention de la formation d'espèces oxygénées activées : ce seront notamment les ralentisseurs d'enzymes responsables de la production d'H2O2, telles que la NADPH oxydase, la xanthine oxydase et les lipoxygénases.
Il apparaît de plus en plus certain que le type de régime alimentaire peut fortement influencer la santé et surtout le développement des maladies vasculaires. La démonstration en a été donnée par des enquêtes de masse qui ont suivi les constatations du "paradoxe français" (voir supra). Mais il n'a pas été jusqu'ici possible d'identifier des composants alimentaires apportant de tels bénéfices. On a retenu la consommation de légumes et de fruits, l'usage de l'huile d'olive et même celui du vin rouge. Chausser des charentaises n'a pas été retenu, ni le port du béret basque, pour expliquer le paradoxe français.Jusqu'ici, l'attention avait été retenue par les antioxydants alimentaires. Force nous est de reconnaître que les résultats des enquêtes ont été décevants. Mais on peut toujours retenir l'hypothèse d'une action antioxydante s'exerçant via l'inhibition des enzymes pro-oxydantes décrites au chapitre XIII. Ces inhibiteurs peuvent ne pas intervenir dans les phénomènes d'oxydo-réduction et passer dès lors inaperçus. Même la mesure du pouvoir antioxydant total d'un aliment pourrait ne pas tenir compte du tout de la présence de ces inhibiteurs. Il s'agit peut-être d'inhibiteurs tels que certains flavonoïdes, le resvératrol, etc ...
1. Les inhibiteurs d'enzymes génératrices de ROS ou antioxydants anticatalytiques
Les travaux qui ont été menés depuis la mise en évidence du "french paradox" ont montré que l'alimentation peut apporter des facteurs de protection anti-athéroscléreux; mais la nature exacte des protecteurs n'est pas encore déterminée46.
a. Inhibiteurs des NADPH oxydases
L'inhibition peut être indirecte, par action sur la PKC, stimulant direct des NOX (figure XIII-7). L'α-tocophérol inhiberait la PKC des fibres musculaires lisses des vaisseaux60.
Le diphényliodonium (DPI) agit sur le FAD et inhibe également les NO synthases64. Ce n'est pas un médicament. L'apocynine65 inhibe partiellement la NADPH oxydase des polynucléaires neutrophiles, mais seulement à de fortes concentrations (10-4M). Sa toxicité est faible. Ces divers inhibiteurs agissent à des concentrations relativement faibles, sont peu antioxydants et ne se révèlent pas lors de dosages globaux des capacités antioxydantes.
L'inhibition des NOX constitue un domaine d'avenir pour la recherche thérapeutique, notamment l'étude de certains flavonoïdes.
b. Inhibiteurs de la myéloperoxydase
Plusieurs inhibiteurs de l'iodination de la thyronine, qui s'opère dans la thyroïde grâce à une myéloperoxydase particulière à cette glande, inhibent efficacement la myéloperoxydase des polynucléaires neutrophiles. Citons le propylthiouracile, le méthimazol et le thiamazol qui sont utilisés depuis des décennies dans le traitement des hyperthyroïdies. Jamais ces inhibiteurs n'ont été utilisés dans d'autres thérapies. Ces divers agents interviennent peu dans l'environnement redox. Un très grand champ de recherches s'ouvre dans ce domaine.c. Inhibiteurs des lipoxygenases
La vitamine E contrôle l'activité de la 12-lipoxygénase, enzyme intervenant dans certaines neurodégénérescences66. Plusieurs produits de synthèse ont été essayés dont le suivant est le dernier en date et semble promis à une carrière de médicament.
Fig. XV-12 : Zyflo : ( + )-1-(1-benzo(b)thièn-2-yléthyl)-1-hydroxyurée.
d. Inhibiteurs des PG synthases
Ces inhibiteurs ont été utilisés avant que l'on ne connaisse les prostaglandines et leur rôle dans l'inflammation : aspirine, phénylbutazone, indométhacine, etc ... Ils sont connus aujourd'hui sous le sigle général AINS (anti-inflammatoires non-stéroïdiens). L'efficacité de l'aspirine dans la prévention de l'agrégation plaquettaire et des accidents cardiovasculaires est bien démontrée et fera l'objet d'une étude détaillée dans le tome II de cette Initiation (L'oxygène en pathologie des mammifères).e. Inhibiteurs de la xanthine oxydase
L'allopurinol est également un vieux médicament inhibant efficacement la xanthine oxydase.2. Les chélateurs de métaux
Les chélateurs de métaux de transition maintiennent ceux-ci à l'état"low-spin" ou font des chélats où existe un empêchement stérique, paralysant la catalyse de la réduction de l'oxygène par ces métaux (voir chapitre VIII).
Fig. XV-13 : Desferrioxamine.
En rouge, les liaisons de coordination.
Ce ligand immobilise complètement le fer au nombre d'oxydation 3 et l'empêche de participer aux réactions d'oxydo-réduction. C'est dans ce cas qu'un ligand mérite vraiment l'appellation chélateur. L'EDTA, par exemple, n'est chélateur du fer que lorsque sa concentration dépasse largement celle du fer, bien que sa structure semble réaliser les mêmes liens que ceux de la desferrioxamine (chapitre VIII, figure VIII-6).
3. Conclusions
La niaiserie est la simplification portée à l'extrême (Le Sage Inconnu)
La fig. XV-14 établit une comparaison entre la défense d'un organisme et celle d'un adversaire faisant face aux milliers de balles tirées par une mitrailleuse. Ce sont des milliers de molécules de ROS que génère une molécule d'enzyme pro-oxydante. Neutraliser celles-ci par des molécules antioxydantes revient à envoyer des missiles contre chaque balle tirée par la mitrailleuse. Cette défense nous paraît absurde. C'est pourtant celle sur laquelle on compte en administrant des composés antioxydants.
Par contre, la deuxième alternative, qui consiste à utiliser des molécules inhibant ou modérant l'enzyme et qui équivaut à envoyer un obus de mortier explosif ou chargé d'un gaz paralysant temporairement les servants de la mitrailleuse, nous apparaît être la solution sensée.
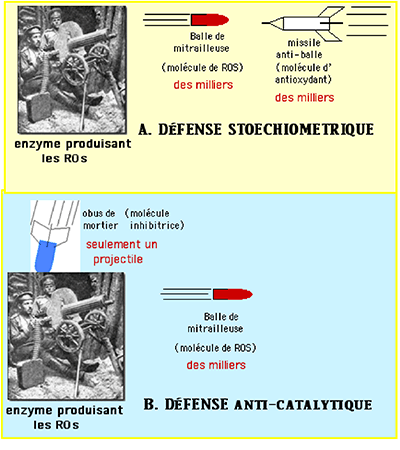
Fig. XV-14 : Un être vivant n'est pas à traiter comme une conserve de viande ou un bidon d'huile d'olive :
c'est un système ouvert brassant de l'oxygène et possédant des enzymes pro-oxydantes.
La défense stœchiométrique apparaît de plus en plus comme une niaiserie. Cependant, les recherches continuent dans ce sens : trouver un antioxydant qui balaiera plus efficacement que les autres la tourbe des peroxydes et des radicaux libres. Très peu de recherches sont entreprises dans le domaine du contrôle des enzymes pro-oxydantes. Il est vrai que le problème était bien plus compliqué que celui des antioxydants stœchiométriques où le modèle in vitro prédominait.
C’était l’absence de modèle fiable qui a retardé la progression dans cette voie.
Depuis l’invention en 2006 d’une nouvelle méthode capable de mesurer l’activité d’une molécule sur une enzyme oxydante, sans interférence possible de cette molécule avec les espèces oxydantes produites par l’enzyme, il devient plus facile de rechercher des inhibiteurs de l’activité des systèmes oxydants catalytiques67. Cette méthode a été conçue au CORD et dénommée SIEFED pour « specific immunoextraction followed by enzymatic detection ». Elle consiste à mettre en contact une enzyme oxydante et une molécule potentiellement inhibitrice de cette enzyme, ensuite à extraire l’enzyme du milieu par fixation sur des anticorps immobilisés, spécifiques pour l’enzyme, puis à révéler l’activité de l’enzyme isolée, fixée sur les anticorps67. Cette méthode a été développée pour la myéloperoxydase des neutrophiles humains et pour celle des neutrophiles équins et déjà appliquée avec succès à la recherche d’inhibiteurs catalytiques de l’enzyme équine68,69. La fig. XV-15 montre le schéma de la méthode SIEFED (fig. XV-15A) et de son application à la recherche d'inhibiteurs de l'activité d'une enzyme (fig. XV-15B). Une méthode SIEFED est en cours de développement pour la NADPH-oxydase des neutrophiles humains.
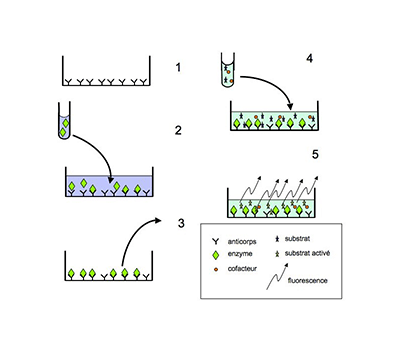
En 1: des anticorps dirigés contre une enzyme sont immobilisés sur support solide; en 2 : l'échantillon contenant l'enzyme est distribué sur les anticorps et l'enzyme est capturée par ceux-ci; en 3 : l'échantillon (et ses composants non fixés par les anticorps) est éliminé; en 4: le substrat de l'enzyme et ses cofacteurs sont ajoutés aux complexes enzyme-anticorps; en 5: l'activité de l'enzyme a transformé le substrat en molécule fluorescente (fluorescence proportionnelle à la quantité de complexes enzyme-anticorps).
Fig. XV-15 : B. Application de la méthode SIEFED à la recherche d'inhibiteurs d'une enzyme (la myéloperoxydase par exemple) . En 1: une solution d'inhibiteurs potentiels est ajoutée à l'échantillon contenant l'enzyme; en 2: l'échantillon contenant l'enzyme et les inhibiteurs est distribué sur les anticorps et l'enzyme est capturée: dans cet exemple, l'inhibiteur interagit avec l'enzyme; en 3: l'échantillon est éliminé: si les inhibiteurs n'ont pas interagi avec l'enzyme, ils seront éliminés; en 4: le substrat de l'enzyme et ses cofacteurs sont ajoutés aux complexes inhibiteur-enzyme-anticorps; en 5: l'activité de l'enzyme a été bloquée par la présence de l'inhibiteur et la transformation du substrat en molécule fluorescente est diminuée.
1. Mills G.CJ. Hemoglobin catabolism. I. Glutathione peroxidase, an erythrocyte enzyme which protects hemoglobin from oxidative breakdown. J Biol Chem. 1957; 229(1): 189-97.
2. Keilin D, Hartree EF. Catalase, peroxidase and metmyoglobin as catalysts of coupled peroxidatic reactions. Biochem J. 1955; 60(2): 310–25.
3. Christophersen BO. Formation of monohydroxy-polyenic fatty acids from lipid peroxides by a glutathione peroxidase. Biochem Biophys Acta. 1968; 164(1): 35-46.
4. Flohé L, Schlegel W. Glutathione peroxidase. IV. Intracellular distribution of the glutathione peroxidase system in the rat liver. Hoppe Seylers Z Physiol Chem. 1971; 352(10): 1401-10.
5. van Kuijk FJ, Dratz EA. Detection of phospholipid peroxides in biological samples. Free Radic Biol Med. 1987; 3(5): 349-54.
6. Brigelius-Flohé R, Aumann KD, Blöcker H, Gross G, Kiess M, Klöppel KD, Maiorino M, Roveri A, Schuckelt R, Usani F, et al. Phospholipid-hydroperoxide glutathione peroxidase. Genomic DNA, cDNA and deduced amino acid sequence. J Biol Chem. 1994; 269(10): 7342-8.
7. Burk RF, Nishiki K, Lawrence RA, Chance B. Peroxide removal by selenium-dependent and selenium-independent glutathione peroxidases in hemoglobin-free perfused rat liver. J Biol Chem. 1978; 253(1): 43-6.
8. Jonas CR, Puckett AB, Jones DP, Griffith DP, Szeszycki EE, Bergman GF, Furr CE, Tyre C, Carlson JL, Galloway JR, Blumberg JB, Ziegler TR. Plasma antioxidant status after high-dose chemotherapy: a randomized trial of parenteral nutrition in bone marrow transplantation patients. Am J Clin Nutr. 2000; 72(1): 181-9.
9. Smith AC, Boyd MR. Preferential effects of 1,3-bis(2-chloroethyl)-1-nitrosourea (BCNU) on pulmonary glutathione reductase and glutathione/glutathione disulfide ratios: possible implications for lung toxicity. J Pharmacol Exp Ther. 1984; 229(3): 658-63.
10. Meister A. Glutathione-ascorbic acid antioxidant system in animals. J Biol Chem. 1994; 269(13): 9397-400. Review.
11. Holmgren A. Hydrogen donor system for Escherichia coli ribonucleoside-diphosphate reductase dependent upon glutathione (DNA synthesis/thioredoxin). Proc Natl Acad Sci USA. 1976; 73(7): 2275-9.
12. Watson WH, Yang X, Choi YE, Jones DP, Kehrer JP. Thioredoxin and its role in toxicology. Toxicol Sci. 2004; 78: 3-14.
13. Nordberg J, Arner ESJ. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system. Free Radic Biol Med. 2001; 31: 1287–1312.
14. Chen Y, Cai J, Murphy TJ, Jones DP. Overexpressed human mitochondrial thioredoxin confers resistance to oxidant-induced apoptosis in human osteosarcoma cells. J Biol Chem. 2002; 277(36): 33242-8.
15. Rhee S, Chae H, Kim K. "Peroxiredoxins: a historical overview and speculative preview of novel mechanisms and emerging concepts in cell signaling". Free Radic Biol Med. 2005; 38(12): 1543–52.
16. Fang J, Lu J, Holmgren A. Thioredoxin reductase is irreversibly modified by curcumin. J Biol Chem. 2005; 280: 25284–90.
17. Abraham NG, Lin JH, Schwartzman ML, Levere RD, Shibahara S. The physiological significance of heme oxygenase. Int J Biochem. 1988; 20: 543–58.
18. Ryter SW, Otterbein LE. Carbon monoxide in biology and medicine. Bioessays. 2004; 26(3): 270-80. Review
19. Eventoff W, Tanakia N, Rossmann MG. Crystalline bovine liver catalase. J Mol Biol. 1976; 103(4): 799-801.
20. Fita I et al. The refined structure of beef liver catalase. Acta Cryst. 1986; B42: 497-515.
21. Mouithys-Mickalad A, Deby C, Deby-Dupont G, Lamy M. An electron spin resonance (ESR) study on the mechanism of ascorbyl radical production by metal-binding proteins. Biometals 1998; 11(2): 81-8.
22. Carrell RW, Winterbourn CC, Rachmilewitz EA. Activated oxygen and haemolysis. Br J Haematol. 1975; 30: 259–64.
23. Giulivi C, Hochstein P, Davies KJA. Hydrogen peroxide production by red blood cells. Free Radic Biol Med. 1994; 16 : 123–9.
24. Balagopalakrishna C, Manoharan PT, Abugo OO, Rifkind JM. Production of superoxide from hemoglobin-bound oxygen under hypoxic conditions. Biochemistry1996; 35 : 6393-8.
25. Nagababu E, Rifkind JM. Heme degradation during autoxidation of oxyhemoglobin. Biochem Biophys Res Comm. 2000; 273 : 839–45.
26. Moureu C, Dufraisse C. Sur l'autoxydation : essai sur le mécanisme de l'action antioxygène. CR Acad Sci (Paris). 1923; 176: 624-9.
27. Harman D. Aging : a theory based on the radical and radiation chemistry. J Gerontology 1956; 11: 298-300.
28. Dufraisse C, Horchois R . Sur la catalyse d'autoxydation: actions antioxygènes ou prooxygènes du fer et de ses composés. CR Acad Sci. (Paris) 1930; 191: 1126-9.
29. Wells WW, Jung C. Regeneration of vitamin C. In Vitamin C in Health and Disease. Packer L and Fuchs J, eds, Marcel Dekker, Inc., New York1997; pp. 109–21.
30. May JM, Cobb CE, Mendiratta S, Hill KE, Burk RF. Reduction of the ascorbyl free radical to ascorbate by thioredoxin reductase. J Biol Chem. 1998; 273: 23039-45.
31. May JM, Mendiratta S, Hill KE, Burk RF. Reduction of dehydroascorbate to ascorbate by the selenoenzyme thioredoxin reductase. J Bio Chem. 1997; 272: 22607-10.
32. Park JB, Levine M. Purification, cloning and expression of dehydroascorbic acid-reducing activity from human neutrophils: identification as glutaredoxin. Biochem J. 1996; 315: 931-8.
33. Dutka D, Pitt M, Pagano D, Mongillo M, Gathercole D, Bonser RS, Camici PG. Myocardial glucose transport and utilisation in patients with type 2 diabetes mellitus, left ventricular dysfunction, and coronary artery disease. J Am Coll Cardiol. 2006; 48: 2225–31.
34. Konya C, Ferdinandy P. Vitamin C: New role of the old vitamin in the cardiovascular system? Br J Pharmacol. 2006; 147: 125–7.
35. de Lorgeril M, Salen P, Paillard F, Laporte F, Boucher F, de Leiris J. Mediterranean diet and the French paradox: Two distinct biogeographic concepts for one consolidated scientific theory on the role of nutrition in coronary heart disease. Cardiovasc Res. 2002; 54: 503-15.
36. Esposito K, Giugliano D. Diet and inflammation: a link to metabolic syndrome and cardiovascular diseases. Eur Heart J. 2006; 27: 15-20.
37. Renaud S, de Lorgeril M. Wine, alcohol, platelets, and the French paradox for coronary heart disease. Lancet. 1992; 339(8808): 1523-6.
38. Duell PB. Prevention of atherosclerosis with dietary antioxidants: fact or fiction? J Nutr. 1996; 126: 1067S -71S.
39. Munday JS, Thompson KG, James KA, Manktelow BW. Dietary antioxidants do not reduce fatty streak formation in the C57BL/6 mouse atherosclerosis model. Arterioscler Thromb Vasc Biol. 1998; 18: 114 -9.
40. Shaish A, George J, Gilburd B, Keren P, Levkovitz H, Harats D. Dietary ß-carotene and {alpha}-tocopherol combination does not inhibit atherogenesis in an ApoE–deficient mouse model. Arterioscler Thromb Vasc Biol. 1999; 19(6): 1470 –5.
41. Asmis R, Jelk J. Vitamin E supplementation of human macrophages prevents neither foam cell formation nor increased susceptibility of foam cells to lysis by oxidized LDL. Arterioscler Thromb Vasc Biol. 2000; 20(9): 2078–86.
42. Törnwall ME, Virtamo J, Korhonen PA, Virtanen MJ, Taylor PR, Albanes D, Huttunen JK. Effect of alpha-tocopherol and beta-carotene supplementation on coronary heart disease during the 6-year post-trial follow-up in the ATBC study. Eur Heart J. 2004; 25(13): 1171-8.
43. Pham DQ, Plakogiannis R. Vitamin E supplementation in cardiovascular disease and cancer prevention: part 1. Ann Pharmacother. 2005; 39(11): 1870-8.
44. Voutilainen S, Nurmi T, Mursu J, Rissanen TH. Carotenoids and cardiovascular health. Am J Clin Nutr. 2006; 83(6): 1265-71. Review.
45. Buijsse B, Feskens EJ, Kwape L, Kok FJ, Kromhout D. Both alpha- and beta-carotene, but not tocopherols and vitamin C, are inversely related to 15-year cardiovascular mortality in Dutch elderly men. J Nutr. 2008; 138(2): 344-50.
46. Siekmeier R, Steffen C, März W. Role of oxidants and antioxidants in atherosclerosis: results of in vitro and in vivo investigations. J Cardiovasc Pharmacol Ther. 2007; 12(4): 265-82. Review.
47. Abudu N, Miller JJ, Attaelmannan M, Levinson SS. Vitamins in human arteriosclerosis with emphasis on vitamin C and vitamin E. Clin Chim Acta. 2004; 339: 11-25.
48. Brown BG, Cheung MC, Lee AC, Zhao X-Q, Chait A. Antioxidant vitamins and lipid therapy. End of a long romance? Arteriosclerosis Thromb Vasc Biol. 2002; 22: 1535-46.
49. Thomson MJ, Frenneaux MP, Kaski JC. Antioxidant treatment for heart failure: friend or foe? QJM. 2008; Dec 17 [Epub ahead of print]
50. Carr AC, Zhu BZ, Frei B. Potential antiatherogenic mechanisms of ascorbate (vitamin C) and alpha-tocopherol (vitamin E). Circ Res. 2000;87:349-54.
51. Podmore ID, Griffiths HR, Herbert KE, Mistry N, Mistry P, Lunec J. Vitamin C exhibits pro-oxidant properties. Nature. 1998; 392: 559.
52. Neuzil J, Weber C, Kontush A. The role of vitamin E in atherogenesis: linking the chemical, biological and clinical aspects of the disease. Atherosclerosis 2001; 157: 257–83. Review.
53. Stocker R. Lipoprotein oxidation: mechanistic aspects, methodological approaches and clinical relevance. Curr Opin Lipidol. 1994; 5: 422-33.
54. Stocker R, Keaney JF. Role of oxidative modifications in atherosclerosis. Physiol Rev. 2004; 84: 1381-478.
55. Ricciarelli R, Zingg JM, Azzi A. Vitamin E: protective role of a Janus molecule. FASEB J. 2001; 15: 2314-25.
56. Brigelius-Flohe R, Traber MG. Vitamin E: function and metabolism. FASEB J. 1999; 13: 1145-55.
57. Munteanu A, Zingg JM, Azzi A. Anti-atherosclerotic effects of vitamin E – myth or reality? J Cell Mol Med. 2004; 8: 59-76.
58. Miller ER, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E. Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality. Ann Intern Med. 2005; 142: 37-46.
59. Azzi A, Stocker A. Vitamin E: non-antioxidant roles. Lipid Res. 2000; 39: 231-55.
60. Azzi A, Breyer I, Feher M, Ricciarelli R, Stocker A, Zimmer S, Zingg JM. Nonantioxidant functions of a-tocopherol in smooth muscle cells. J Nutr. 2001; 131: 378S–81S.
61. Azzi A, Ricciarelli R, Zingg JM. Non-antioxidant molecular functions of K-tocopherol (vitamin E). FEBS Lett. 2002; 519: 8-10. Minireview.
62. Brigelius-Flohé R, Kelly FJ, Salonen JT, Neuzil J, Zingg JM, Azzi A. The European perspective on vitamin E: current knowledge and future research. Am J Clin Nutr. 2002; 76: 703–16.
63. Young AJ, Lowe GM. Antioxidant and prooxidant properties of carotenoids. Arch Biochem Biophysics. 2001; 385: 20–27. Minireview.
64. O'Donnell BV, Tew DG, Jones OT, England PJ. Studies on the inhibitory mechanism of iodonium compounds with special reference to neutrophil NADPH oxidase. Biochem J. 1993; 290: 41-9.
65. Dodd-O JM, Pearse DB. Effect of the NADPH oxidase inhibitor apocynin on ischemia-reperfusion lung injury. Am J Physiol Heart Circ Physiol. 2000; 279: H303–2.
66. Khanna S, Roy S, Ryu H, Bahadduri P, Swaan PW, Ratan RR, Sen CK. Molecular basis of vitamin E action: tocotrienol modulates 12-lipoxygenase, a key mediator of glutamate-induced neurodegeneration. J Biol Chem. 2003; 278(44): 43508-15.
67. Franck T, Kohnen S, Deby-Dupont G, Grulke S, Deby C, Serteyn D. A specific method for measurement of equine active myeloperoxidase in biological samples and in in vitro tests. J Vet Diagn Invest. 2006; 18: 326-34.
68. Kohnen S, Franck T, Van Antwerpen P, Zouaoui Boudjeltia K, Mouithys-Mickalad A, Deby C, Moguilevsky N, Deby-Dupont G, Lamy M, Serteyn D. Resveratrol inhibits the activity of equine neutrophil myeloperoxidase by a direct interaction with the enzyme. J Agric Food Chem. 2007; 55: 8080-7.
69. Franck T, Kohnen S, Grulke S, Neven P, Goutman Y, Peters F, Deby-Dupont G, Serteyn D. Inhibitory effect of curcumin and tetradydrocurcumin on equine activated neutrophils and myeloperoxidase activity. Physiol Res. 2008; 57(4): 577-87.