 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)  Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène et la vie: tome 1 - Intitiation au métabolisme de l'oxygène
C Deby et G Deby-Dupont
Chapitre IV: Les oxydo-réductions en biologie
Cells and tissues must maintain a reducing environment to survive
FQ Shafer and GR Buettner (2003)
L'existence cellulaire est liée à la stabilité d'une balance entre phénomènes réducteurs et oxydants. Ces phénomènes résultent de rapports précis entre les partenaires de divers couples redox dont les valeurs s'additionnent et qui diffèrent selon les compartiments cellulaires considérés. L'ajustement des rapports dépendent en premier lieu d'enzymes : les oxydoréductases.
Un grand nombre de fonctions cellulaires sont régies par la situation oxydo-réductrice du milieu où elles se déroulent. Il est nécessaire de définir de la manière la plus précise possible cette situation.1. Généralités sur les mécanismes oxydo-réducteurs en biologie
a. Considérations théoriques
On peut considérer, avec les travaux de Marcus, que le rapprochement d'une molécule organique donneuse d'électrons D avec une molécule acceptrice A, en milieu aqueux, aboutit, moyennant une fourniture d'énergie ε, à la formation d'un exciplexe, c'est-à-dire une cage constituée de molécules d'eau emprisonnant A et D ; ceux-ci sont rapprochés par la contraction de l’enceinte, ce qui facilite le passage d'un électron de D vers A (fig. IV-1).
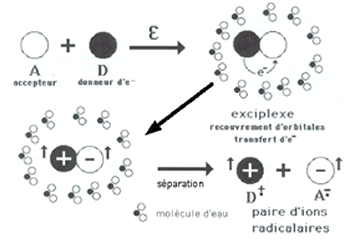
Fig. IV-1 : Hypothèse de Marcus. Les flèches verticales symbolisent les électrons
devenus célibataires. Il y a formation de deux ions radicalaires : D•+ et A-•.
Ces phénomènes peuvent être spontanés, mais le plus souvent ils requièrent une fourniture d'énergie et sont sous la dépendance des oxydoréductases
b. Concepts actuels sur l'état et l'environnement redox
Pendant des décennies, une certaine confusion a régné dans la littérature à la suite des travaux de base de Krebs (1967) et de Bücher et Klinkenberg (1958). Il fut question de potentiel d'électrode, puis de couples redox, de potentiel redox, pour revenir à la notion d'état redox proposée par Krebs (1967). Nous adopterons les définitions de Schafer et Buettner (2002, 2003).
1) Etat redox :
Cette grandeur définit le potentiel redox d'un couple considéré isolément ; elle est spécifique de ce couple. Elle dépend de deux facteurs :
a. le potentiel moyen du couple dont l'exemple est donné par la fig. IV-2
b. la capacité réductrice du couple : se réfère à la concentration des composants réducteurs du couple, exprimant la "force réductrice" du tampon redox.
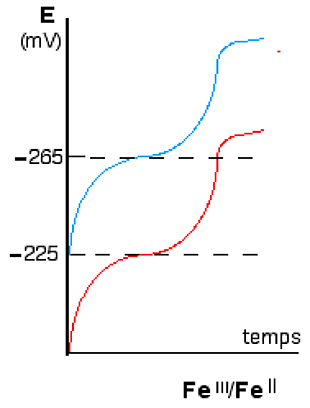
Fig. IV-2 : Potentiel moyen du couple FeIII/FeII.
2) Environnement redox :
C'est la sommation des états redox des couples oxydo-réducteurs les plus abondants dans un milieu biologique. Comme nous le développerons plus loin, les environnements redox varient avec les organelles considérées.
3) Intervention de systèmes enzymatiques
Les oxydoréductases comprennent les deshydrogénases, les oxydases et les réductases (voir chapitre VI). Toutes ces enzymes catalysent les réactions d'oxydo-réduction. Rappelons à nouveau que le substrat oxydé est le donneur d'électron, tandis que celui qui est réduit est l'accepteur.
Le terme oxydase n'est utilisé que dans les cas où c'est O2 qui est l'accepteur (Enzyme Nomenclature, 1992, p.9). C'est généralement par une variation d'activité des oxydoréductases que sont modifiés les environnements redox.
2. Principaux couples régulant l'environnement redoxNous verrons au chapitre XII que les phénomènes rédox jouent un rôle-clé dans la production d'énergie en abaissant très progressivement le potentiel des molécules catabolisées ("la cellule a besoin de petite monnaie", disait Michaélis). C'est par transfert d'électrons, migrant étape par étape vers le niveau d'énergie le plus bas qui est celui de l'eau, que s'effectue cette lente libération d'énergie.
a. Glutathion
Ce tripeptide, par sa grande abondance, joue le rôle principal dans la détermination de l'environnement redox. C'est le principal tampon redox des cellules, où sa concentration est de l'ordre de la millimolarité (de 1 à 11 mM dans le cytosol).
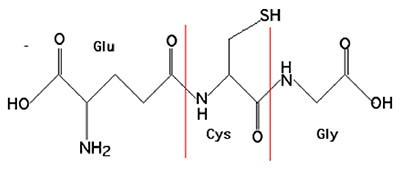
Fig. IV-3 : Glutathion ( γ-glutamylcystéinylglycine )
Le soufre S des fonctions -SH passe aisément à l'état radicalaire en cédant un électron à une molécule oxydante et en libérant un proton. C'est le cas du glutathion:
GSH => GS• + e- + H+GS• est le radical glutamyl qui dimérise :
GS• + •SG => GS-SGLes mesures des concentrations en GSH et disulfure effectuées dans les compartiments intracellulaires ont permis d'évaluer leur environnement redox. Le réticulum endoplasmique est la partie ayant l'environnement le plus oxydant : -170 mV avec un rapport GSH/GSSG entre 1:1 et 3:1, tandis que le cytosol constitue un milieu plus réducteur (-289 mV et un rapport de 3300:1).
Le glutathion intervient dans le fonctionnement de la GSH peroxydase (voir chapitre XV). Cette enzyme s'attaque au peroxyde d'hydrogène (H2O2 ou HOOH) et aux hydroperoxydes organiques ROOH (voir chapitre X). Le peroxyde d'hydrogène est réduit en 2 molécules d'eau tandis que les hydroperoxydes donnent une molécule d'alcool R-OH + une molécule d'eau (fig. IV-4 A).
Les radcaux GS• dimérisent et deviennent un disulfure GS-SG. Pour permettre à la GSH peroxydase de continuer son activité, les molécules de disulfures sont réduites par une autre enzyme, la GSH réductase qui exige du NADPH comme cofacteur (fig. IV-4 B).
Remarquer ici que le nombre d'oxydation du soufre ne change pas : la réduction porte sur la molécule GSSG qui accepte 2 électrons.
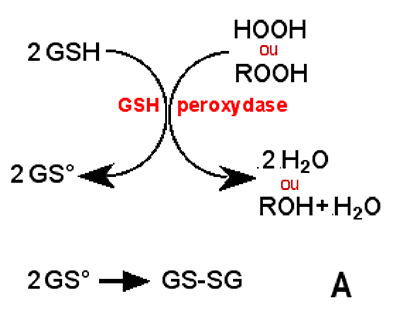
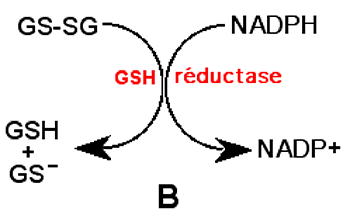
Fig. IV-4 : A. Le glutathion (GSH) intervient comme co-facteur dans la GSH peroxydase. R peut être une chaîne carbonée (ROOH : lipoperoxyde) ou un atome d'hydrogène (H2O2 : peroxyde d'hydrogène) (d'après Meister, 1993). |
b. Thiorédoxines (Trx)
Ces petites protéines (11-12 kDa) sont porteuses de 2 résidus cystéinyles rapprochés [Trx(SH)2] qui peuvent devenir des disulfures :Trx(S-S).
Des couples redox se forment de cette manière Trx(S-S), 2H+ / Trx(SH)2. Plus spécifiques que le GSH, ces protéines ne réagissent qu'avec un nombre limité (une trentaine) de substances. Le couple redox présente un potentiel de - 240 mV. Les thiorédoxines forment, avec leurs réductases, des systèmes importants pour la protection de la cellule vis-à-vis des ROS (voir chapitre XV). Les Trx sont considérées comme des protéines donneuses universelles d'atomes d'hydrogène H•, en présence de thiorédoxine réductases. L'oxydation des ponts disulfures dans une enzyme modifie considérablement sa structure et son activité enzymatique.
c. NADPH et NADH
Ces coenzymes participent à un nombre élevé de réactions enzymatiques, tant chez les mammifères que chez les autres eucaryotes. Le nicotinamide adénine dinucléotide phosphate forme le couple NADP+/NADPH au cours de la réaction :
NADPH ==> NADP+ + H+ + 2 e-
Fig. IV-5 : Réduction de l'oxygène par une enzyme qui capte les 2 électrons disponibles de NADPH
pour les transférer à deux molécules d'oxygène, produisant des molécules d'anion superoxyde.
Le départ des 2 électrons de N est provoqué par leur capture par une molécule plus avide d'e- (plus haute dans l'échelle rédox, autrement dit, plus oxydante). Une telle molécule est souvent, mais indirectement, l'oxygène, comme c'est le cas dans une des réactions rédox les plus importantes régies par ces coenzymes qui est celle catalysée par les NAD(P)H oxydases : elle est schématisée sur la fig. IV-6. Entre NADPH et O2 existent des oxydants intermédiaires, décrits au chapitre XIII. La partie active de ces coenzymes est la nicotinamide.
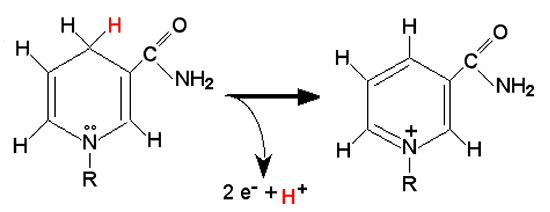
Fig. IV-6 : Partie active des NAD(P)H. R représente le reste de la chaîne. L'oxydation porte sur l'atome
d'azote qui perd deux électrons et dont le nombre d'oxydation passe de 3 à 5.
Ce changement
entraîne un remaniement de la structure et l'élimination d'un cation hydrogène (H+).
Avec un potentiel de - 374 mV, le couple NADPH/NADP+ exerce un effet majeur dans le maintien d'un environnement réducteur.
d. Acide ascorbique (ou vitamine C)
Le potentiel rédox modérément négatif (-0,29 V) du couple acide ascorbique/radical ascorbyle place la vitamine C dans une situation intermédiaire où elle peut jouer le rôle d'accepteur d'électron, comme dans le fonctionnement d'une peroxydase, ou d'oxydant, vis-à-vis du glutathion par exemple. L'importance de la vitamine C est prouvée par la rapidité avec laquelle se manifestent les symptômes de carence (scorbut).
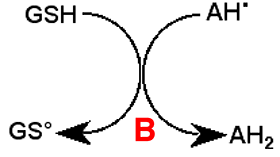
B : Le GSH dont le potentiel redox est plus négatif que celui de l'acide ascorbique régénère celui-ci. Le radical GS• dimérise aisément et le GSH est régénéré à son tour (fig. IV-4).La réaction d’Udenfriend et ses dérivées
En 1954, Udenfriend et coll. découvrirent que le fer complexé par l’EDTA (voir figures VIII-4 et 5) oxyde divers substrats en présence d’ascorbate et d’oxygène. L’ascorbate semble se comporter comme un véritable pro-oxydant. En réalité, l’ascorbate réduit le fer complexé auquel est fixé une molécule d’oxygène, ce qui forme un système redox analogue aux ions ferryles, capable d’oxyder des substrats tels que des acides polyinsaturés .
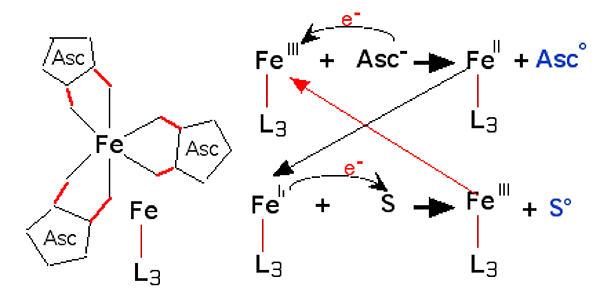
| Fig. IV-8 : Une réaction d’oxydation dérivée de celle d’Udenfriend : l’ascorbate (Asc) sert d’abord à complexer le fer (3 molécules par atome : schéma de gauche) ; puis, d’autres molécules d’ascorbate réduisent le fer ferrique en ferreux et deviennent des radicaux ascorbyles (Asc•) ; le fer ferreux complexé par l’ascorbate forme un ion ferryle avec une molécule d'oxygène (voir chapitre VIII) et oxyde divers substrats S (par exemple un lipide non saturé) dont les molécules deviennent des radicaux libres (SOO•). L3 = les 3 molécules d’ascorbate ligandes. |
Le radical ascorbyle
C'est un radical très stable grâce à une résonance efficace (fig. IV-9). C'est un des rares radicaux peu réactionnels avec les singulets. On peut le mettre en évidence dans le sang circulant. Sa toxicité est très faible. Ces propriétés de stabilité font que sa molécule d'origine, l'ascorbate, constitue le modèle de radical scavenger : elle réduit les radicaux agressifs en devenant un doublet inoffensif.
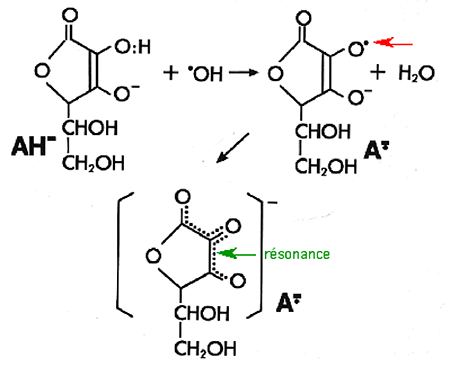
| Fig. IV-9 : "Scavenging" d'un radical libre par l'ion ascorbate AH-. L'ion ascorbyl A• se forme. La flèche rouge indique l'électron célibataire. Cet électron subit un processus de délocalisation sur les atomes d'oxygène : c'est la résonance symbolisée sur la figure du bas par un pointillé (indiqué par la flèche verte). |
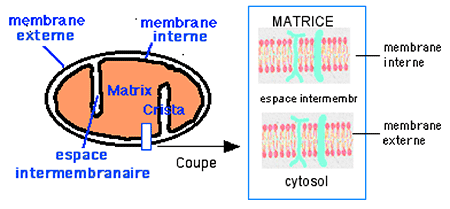
Fig. IV-10 : Coupe schématique d'une mitochondrie : la membrane externe sépare l'organelle ; c'est une double couche phospholipidique traversée par des canaux protéiques. La membrane interne, de même architecture, délimite les espaces membranaires la séparant de la membrane externe. La membrane interne fait des replis en forme de crêtes (cristae) et délimite un espace central : la matrice. A droite du dessin : agrandissement d'une coupe transmembranaire. |
a. La chaîne de transport d'électrons
Dans la matrice mitochondriale se situent les enzymes du cycle de Krebs qui extraient des acides gras à 6 et 4 carbones, du CO2, des électrons et des protons. Les électrons sont repris par une chaîne enzymatique, logée dans la membrane interne, à 4 constituants: les complexes protéiques I, II, III et IV.
Fig. IV.11 : L'entrée des électrons provenant du cycle de Krebs se fait par le complexe I (CoI) ou le complexe II (CoII). Chacun des deux complexes donne ses électrons à l'ubiquinone. De là, les e- entrent dans le complexe III puis réduisent le fer hémique des molécules mobiles de cytochrome c. Celles-ci sont réduites par le cytochrome IV et retournent chercher un électron auprès du CoIII. Le cytochrome c se comporte comme une navette de transport, opérant dans l'espace intermembranaire. Finalement, les électrons sont utilisés par le pôle matriciel du CoIV pour réduire une molécule d'oxygène en 2 molécules d'eau. Le bilan final de ces transferts d'électrons est: O2 + 4e- + 4 H+ ===> 2 H2O + 18 kCal
L'énergie de cette réaction est très grande, provoquant une forte élévation de température. In vitro, elle dégage 76 kJ(oules), car E’o (1/2O2/H2O) = 820 mV
Dans la mitochondrie, les électrons perdent progressivement leur énergie qui sera utilisée par l'ATPase pour la formation d'ATP, et la réaction finale ne produit qu'une faible élévation de température, l'énergie initiale ayant été perdue par petits "paquets", selon l'expression de Michaélis. Ces petites quantités d'énergie sont utilisées par des "pompes" à proton réparties dans les complexes I, II et III qui extraient des H+ de la matrice pour les déverser dans les espaces intermembranaires. Ainsi se crée un gradient de protons de part et d’autre de la double membrane interne, le côté « espace intermembranaire » étant électropositif par rapport au côté matriciel.
La libération d'électrons au niveau du cycle de Krebs s'accomplit dans des états redox très négatifs. Puis, à chaque étape du transfert des électrons vers l'oxygène, le potentiel redox s'élève (devient moins négatif) et une certaine énergie est chaque fois libérée (fig. IV-12).
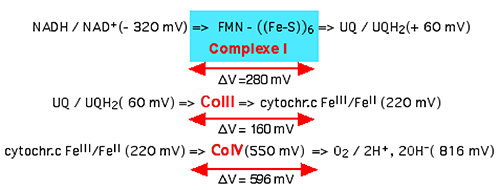
| Fig. IV.12 : La montée de potentiel (ce qui signifie la libération d’une certaine énergie) depuis le départ des électrons libérés par le cycle de Krebs jusqu’à la réduction de la molécule d’oxygène. |
b. La phosphorylation de l’ADP
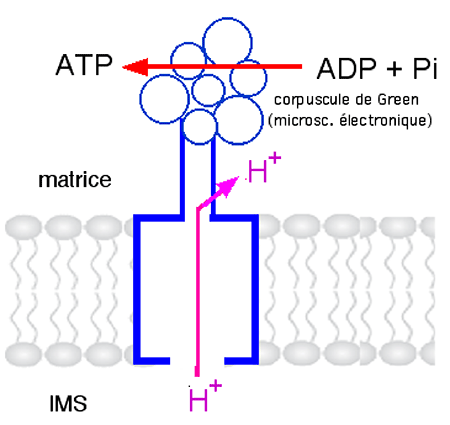
| Fig. IV.13 : Fonctionnement de l’ ATP synthase : l’énergie dépensée pour pomper des protons dans l’espace intermembranaire (IMS) est rendue par le retour des H+ dans la matrice et permet à la réaction endothermique de synthèse de l’ATP de s’accomplir. |
4. Bibliographie
Oxydoréductases
Enzyme Nomenclature. 1992, Academic Press, San Diego, California.Théorie de Marcus
Marcus RA, Sutin N. Electron transfer in chemistry and in biology. Biochemica et Biophysica Acta. 1985; 811: 265-322.
Kavarnos GJ, Turro NJ. Photosensitization by reversible electron transfer : theories, experimental evidence, and examples. Chemical Review. 1985; 86: 441-449.
Eberson L. The Marcus theory of electron transfer, a sorting device for toxic compounds. Advances in Free Radicals in Biology and Medicine. 1985; 1: 19-90.
Bauld NL. Radicals, ion radicals and triplets. Wiley-VCH, New York, 1997, pp. 184-197.Glutathion
Meister A. Approaches to the therapy of glutathione deficiency. In: Free radicals from basic science to medicine, G Poli, E Albano, MU Dianzani, eds, Birkhaüser Verlag, Basel, 1993, pp.489-505.Acide ascorbique
Ascorbic Acid : Chemistry, Metabolism, and Uses. PA. Seib, BM Tolbert, eds. Advances in Chemistry series 200. American Chemical Society, Washington DC, 1982, 590 pages.Thiorédoxine
Holmgren A. Thioredoxine and glutaredoxin systems. Minireview. Journal of Biological Chemistry, 1989; 264: 13963-13966.
Sandalova T, Zhong L, Lindqvist Y, Holmgren A, Schneider G. Three-dimensional structure of a mammalian thioredoxin reductase: Implications for mechanism and evolution of a selenocysteine-dependent enzyme. Proceedings of the National Academy of Sciences USA. 2001; 98: 9533–9538.
| Initiation au métabolisme de l'oxygène: chapitre cinq |