 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)  Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'Oxygène et la Vie: Tome II - L'Oxygène en Pathologie des Mammifères
Mitochondries et métabolisme de l'oxygène
Première partie : Mitochondries et oxygénation
Carol Deby
Chapitre VIII : Protection anti-ROS mitochondriale
| Note: pour la facilité de la lecture, 1. chaque référence dans le texte comporte un lien vers les pages de bibliographie 2. les abréviations et formules chimiques sont reprises dans les pages du glossaire; elles sont également identifiées directement dans le texte (apparition en arrière plan lors du pointage de la souris) |
Dès 1985, Guarnieri considérait les mitochondries comme les lieux les plus importants de peroxydation des membranes, devant notamment léser l'ETC (Guarnieri, 1985). On estime actuellement que ces organelles sont les sites majeurs de risque de peroxydation, pouvant léser leurs membranes interne et externe, avec comme conséquence immédiate, des troubles graves du transport d’électron le long de la chaîne ETC (Guarnieri, 1985; Arai et al., 1996).
Il n'est donc pas étonnant qu'un nombre élevé de systèmes protecteurs, anti-radicalaires et antilipoperoxydants, aient été découverts dans ces organelles.
La défense naturelle comprend des petites molécules thiolées dont le chef de file est le glutathion GSH; rappelons le rôle capital joué par le rapport GSH/GSSG ; nous invitons le lecteur à relire le chapitre IV à ce sujet.
Mais la lutte naturelle contre les ROS est essentiellement enzymatique. Elle comprend :
• la superoxyde dismutase à manganèse (MnSOD ou SOD-2) et celle à fer et à cuivre (Li et al., 1995),
• la glutarédoxine mitochondriale (Grx-2a) (Gladyshev et al., 2001),
• la peroxyrédoxine (Rhee et al., 2005),
• la glutathion/phospholipide hydroperoxyde glutathion peroxydase (GSH/PHGPx [GPx4]) (Knopp et al., 1999),
• la catalase (Radi et al., 1991),
• le système à la thiorédoxine 2 (Trx-2) (Miranda-Vizuete et al., 2000).
Les systèmes Trx-2, Grx-2a et MnSOD sont des protéines spécifiques des mitochondries (Vlamis-Gardikas et Holmgren, 2002). La peroxyrédoxine 3 joue également un rôle important, ainsi que le cytochrome c.
Ces protections n'empêchent pas une partie du peroxyde d'hydrogène de sortir de la mitochondrie (Löschen et al., 1971, 1973, 1974).
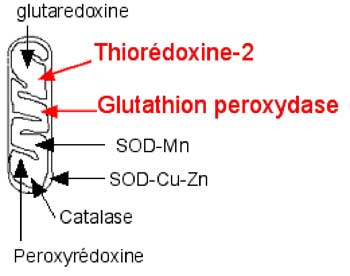
| Fig. VIII-1 : Les enzymes supprimant les premiers stades de la réduction de l'oxygène. Les SODs réduisent considérablement les chances de rencontre d’O2• et de •NO produisant du peroxynitrite. Les autres enzymes s'attaquent au peroxyde d'hydrogène. En rouge : les peroxydases les plus abondantes. |
A. Les superoxyde dismutases
Elles permettent de maintenir aux environs de 10-11M la concentration intramatricielle de l'anion superoxyde (O2•) (Chance et al., 1979).
![]()
Elles réduisent ainsi les probabilités de rencontre de l'anion superoxyde et du monoxyde d'azote (•NO), produisant le peroxynitrite (ONOOH) qui libère, en-dessous de pH 9, deux agents très agressifs, le radical hydroxyle (•OH) et l'oxyde nitreux, qui peuvent exister durant des microsecondes grâce à un effet-cage dû aux molécules d'eau orientées.

A l'ouverture de la "cage", les •OH réagissent sur place (flash) tandis que les radicaux NO2• peuvent se déplacer de quelques angströms.
1. La superoxyde dismutase à manganèse (Mn-SOD)
Pour l’expression de la Mn-SOD, voir Aiken et al., 2008.
Cette SOD est liée à la membrane interne, mais existe surtout dans la matrice (Melov, 2000; Oberley et al., 2004); c'est une protéine mitochondriale encodée dans le noyau (Zhang, 1996; Friedman et al., 2001). En surexpression et liée à une séquence peptidique ciblant les mitochondries, elle protège efficacement contre les ROS, notamment celles issues d’une exposition à une radiation ionisante (voir plus bas).
2. La superoxyde dismutase à Cu et Zn (Zn-Cu-SOD)
Si cette SOD prédomine dans le cytosol, on la retrouve également dans les espaces intermembranaires (Okado-Matsumoto et Fridovich 2001; Vande Velde et al, 2008). Son gène est nucléaire.
Le cuivre de cette SOD pourrait jouer un rôle néfaste en favorisant la production de ROS dans les espaces intermembranaires (Goldsteins et al., 2008).
B. Le système à la thiorédoxine-2 (Trx-2)
Voir chapitre IV,3.B
Rappelons que la Trx-2 est très résistante aux attaques oxydantes.
C. La glutathion peroxydase (GPx)
Revoir les propriétés du glutathion dans le chapitre IV.
1. Structure
C’est une glycoprotéine tétramérique contenant 4 sélénocystéines. Chaque monomère pèse environ 21 kDa (Arai et al., 1996).
On dénombre actuellement 4 isoformes dans les cellules des mammifères, mais c’est la GPx1 qui est la plus abondante dans le cytosol où elle prédomine ; dans les mitochondries, elle est moins abondante.
Fig. VIII-2: Structure de la GPx1.
Avec la GSH réductase, une enzyme à flavine utilisant le NADPH, la GPx constitue un cycle de réduction du peroxyde d'hydrogène. Cette enzyme est codée dans le noyau et importée dans les mitochondries (Arai et al., 1996).
2. Le système GPx/GSSG réductase
Ce sont Flohé et Schlegel (1971) qui ont mis en évidence les deux enzymes dans la matrice des mitochondries. Ce système joue un rôle plus important que la catalase (Simmons et Jamall, 1989) dont l'activité est relativement faible. Un flux continu d'équivalents réducteurs passe à travers le système redox mitochondrial 2GSH/GSSG (Oshino et Chance, 1977).
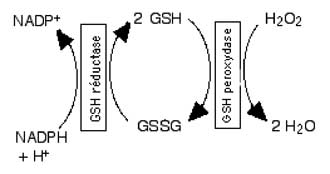
Fig. VIII-3 : Schéma de fonctionnement du système GSH peroxydase-GSH réductase.
Dans la figure VIII-3, c'est le peroxyde d'hydrogène, HOOH, qui est pris comme exemple, mais la GSH peroxydase accepte aussi comme substrats les peroxydes lipidiques ROOH (R : chaîne d'acide gras insaturé), la fonction -OOH devenant une fonction alcool -OH.
D. Les glutathion-S-transférases (GST)
Pour une revue, voir Hayes et al., 2005.
Les glutathion transférases (EC.2.5.1.18) catalysent des réactions nucléophiles du GSH avec des composés apolaires contenant un atome électrophile : carbone, azote ou soufre. Ces enzymes sont des agents de détoxification ; leurs substrats sont divers, mais nous ne citerons, dans le cadre de cette étude, que les carbonyles insaturés en α ou β, notamment les aldéhydes provenant de la décomposition des lipoperoxydes. Les GST mitochondriales constituent une famille comprenant de nombreuses isoformes, induites par les stress oxydants (Raza et al., 2002).
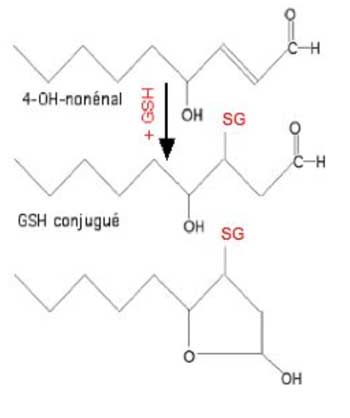
| Fig. VIII-4 : Conjugaison du 4-hydroxynonénal, dérivé très toxique d'hydroperoxydes d'acides polyèniques, en présence d'une GSH-S-transférase. |
E. La glutathionylation
Voir les revues : Gallogly et Mieyal, 2007; Shelton et Mieyal, 2008.
La S-glutathionylation est une transformation, réversible, d'une protéine, qui protège les sites cystéinyls d'une oxydation intempestive et irréversible par un ROS. Une molécule de GSH crée un pont disulfure avec la fonction thiol du site cystéinyl à protéger.
-XXX-Cyst (SH)-XXX- ===> -XXX-Cyst (S-S-G)-XXX-
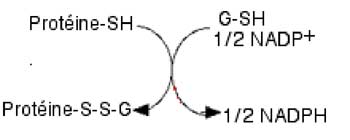
Fig. VIII-5 : Mécanisme hypothétique de la glutathionylation par une enzyme inconnue.
Cette opération protectrice est réalisée avec le concours d'une molécule de GSH, sous le contrôle d'un mécanisme encore peu clair (Gallogly et Mieyal, 2007) et affecte des protéines impliquées dans la transmission des signaux : actine (Wang et al., 2001, 2003), Ras (Adachi et al., 2004), les « protein tyrosyl » phosphatases (Barrett et al., 1999).
La glutathionylation des protéines augmente durant l'ischémie-reperfusion cardiaque.
L'opération inverse, la déglutathionylation, a un mécanisme maintenant bien connu : c'est par l'activité d'une glutarédoxine (Grx) qu'elle s'effectue (Chrestensen et al., 2000; Jung et Thomas, 1996). Diverses étapes ont été proposées qui sont discutées dans une revue récente (Gallogly et Mieyal, 2007).
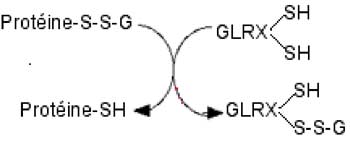
Fig. VIII-6 : Mécanisme hypothétique de la déglutathionylation par une glutarédoxine (GLRX).
Elle constitue une modification post-translationelle réversible d'une grande importance dans la régulation redox de l'activité des protéines; elle régule aussi les fonctions cellulaires associées à ces activités. Les cytokines peuvent être soumises à la glutathionylation.
F. La catalase
C’est une hémoprotéine monomérique permettant la réaction :
2 H2O2 ⇒ 2 H2O + O2
On trouve dans la mitochondrie une catalase (mitCAT) générée par les mitoribosomes, mais aussi de la catalase importée du cytosol.
La catalase fut d’abord considérée comme l'enzyme principale qui permet à la mitochondrie de maintenir en dessous de 10-7M la concentration en H2O2 (Chance et al., 1979; Chance et Oshino, 1971).
Puis, sa présence dans la mitochondrie fut contestée ! Son existence intramitochondriale a été définitivement démontrée dans le cœur par des critères biochimiques et immunochimiques (Radi R et al., 1991) et dans le foie (Salvi et al., 2007). Le gène mCAT est codé sur le DNA mitochondrial (Schriner et al., 2005). Aujourd'hui, on sait que les enzymes thiolées sont plus impliquées que la catalase dans la protection de la mitochondrie. Mais, comme dans le cas de la MnSOD, le couplage de la catalase à une séquence peptidique ciblant les mitochondries, augmente considérablement son activité protectrice (voir ci-dessous).
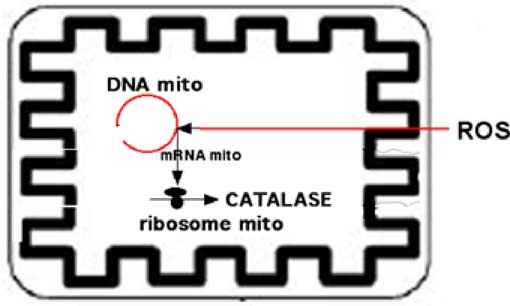
Fig. VIII-7 : Rôle de la catalase dans la protection contre les ROS.
G. Un rôle important de la Trx2
Wang et al. (2006) ont montré que la thiorédoxine 2 contrôle la perméabilisation de la membrane externe et le niveau des Bcl-xL.
H. Protection de l’ETC par la TrxR
La thiorédoxine réductase, en réduisant l’ubiquinone, protège l’ETC contre un stress oxydant (Xia et al., 2003).
I. Les peroxyrédoxines (Prx)
Nous avons étudié les généralités sur ces enzymes antioxydantes dans le chapitre IV.3.F.
La peroxyrédoxine III est une peroxydase spécifique de la mitochondrie, qui régule l’apoptose intrinsèque de la cellule (Chang et al., 2004). Elle est synthétisée dans le cytosol pour être transférée dans les mitochondries. Dans des expériences d’interférences pratiquées sur des cellules HeLa, Chang et al., en 2004, ont démontré que le manque de Prx3 augmente la concentration intracellulaire en peroxyde d’hydrogène, notamment dans les mitochondries, et sensibilise les cellules à l’apoptose provoquée par la staurosporine ou le TNF-α.
J. Le cytochrome c
Il ne faut pas perdre de vue qu'un piégeur d'anion superoxyde, dans les espaces intermembranaires, est le cytochrome c qui est assez abondant dans ces régions mitochondriales.
O2• + cyt c (Fe3+) ⇒ O2 + cyt c (Fe2+) (Han et al., 2003)
2. Les moyens de défense anti-ROS thérapeutiques
Deux sites sont considérés actuellement comme nécessitant une haute protection contre les ROS :
• le canal K+ATP dont l’intégrité est liée à la fermeture des mPTP,
• le complexe cytochrome c/cardiolipine où il faut inhiber la fonction peroxydasique du cytochrome. Comme le suggèrent Kagan et al. (2009b), « l‘inhibition de l’activité peroxydasique peut être une nouvelle approche de la régulation de la mort cellulaire par apoptose ».
A. Inefficacité des piégeurs stœchiométriques « classiques »
Nous avons vu dans l’Initiation au métabolisme de l’Oxygène que la protection par les piégeurs stœchiométriques de ROS, efficaces dans la conservation des huiles insaturées dans un rapport de 1 molécule piégeuse à 6000 molécules à protéger, avait subi avec le plus total insuccès l’épreuve des grands « trials » cliniques.
Pire, certains piégeurs hautement recommandés, comme le tocophérol, s’étaient avérés nuisibles, même aux doses habituellement recommandées (Miller et al., 2005; Szeto, 2006a). Ces antioxydants classiques, y compris les polyphénols, n’atteignent pas les mitochondries.
Le lecteur sceptique quant à cette faillite des antioxydants classiques utilisés classiquement consultera avec intérêt, outre l’initiation au métabolisme de l’oxygène (chapitre XV), les références suivantes :
- Clarke R and Armitage J. Antioxidant vitamins and risk of cardiovascular disease. Review of large-scale randomised trials. Cardiovasc. Drugs Ther. 16 (2002), pp. 411–415.
- Devaraj S, Tang R, Adams-Huet B, Harris A, Seenivasan T, de Lemos JA and Jialal I. Effect of high-dose alpha-tocopherol supplementation on biomarkers of oxidative stress and inflammation and carotid atherosclerosis in patients with coronary artery disease. Am. J. Clin. Nutr. 86 (2007), pp. 1392–1398.
- Hennekens CH, Buring JE, Manson JE, Stampfer M, Rosner B, Cook NR, Belanger C, LaMotte F, Gaziano JM, Ridker PM, Willett W and Peto R. Lack of effect of long-term supplementation with beta carotene on the incidence of malignant neoplasms and cardiovascular disease. N. Engl. J. Med. 334 (1996), pp. 1145–1149.
- Leppala JM, Virtamo J, Fogelholm R, Huttunen JK, Albanes D, Taylor PR and Heinonen OP. Controlled trial of alpha-tocopherol and beta- carotene supplements on stroke incidence and mortality in male smokers. Arterioscler. Thromb. Vasc. Biol. 20 (2000), pp. 230–235.
- Miklya I, Knoll B and Knoll J. A pharmacological analysis elucidating why, in contrast to (−)-deprenyl (selegiline), alpha-tocopherol was ineffective in the DATATOP study. Life Sci. 72 (2003), pp. 2641–2648.
- Omenn GS, Goodman GE, Thornquist MD, Balmes J, Cullen MR, Glass A, Keogh JP, Meyskens FL, Valanis B, Williams JH, Barnhart S and Hammar S. Effects of a combination of beta carotene and vitamin A on lung cancer and cardiovascular disease. N. Engl. J. Med. 334 (1996), pp. 1150–1155
- Pratico D. Evidence of oxidative stress in Alzheimer's disease brain and antioxidant therapy: lights and shadows. Ann N Y Acad Sci. 1147 (2008), pp. 70–78
- Stephens NG, Parsons A, Schofield PM, Kelly F, Cheeseman K and Mitchinson MJ. Randomised controlled trial of vitamin E in patients with coronary disease: Cambridge Heart Antioxidant Study (CHAOS). Lancet 347 (1996), pp. 781–786.
-Tornwall ME, Virtamo J, Haukka JK, Albanes D and Huttunen JK. Alpha-tocopherol (vitamin E) and beta-carotene supplementation does not affect the risk for large abdominal aortic aneurysm in a controlled trial. Atherosclerosis 157 (2001), pp. 167–173.
- Yusuf S, Dagenais G, Pogue J, Bosch J and Sleight P. Vitamin E supplementation and cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N. Engl. J. Med. 342 (2000), pp. 154–160.
B. Nouvelles stratégies thérapeutiques ciblant les mitochondries
Nous avons vu au chapitre V l’importance de l’adressage qui dirige les protéines synthétisées dans le cytosol vers les mitochondries ; cet adressage est permis par des séquences peptidiques possédant un tropisme pour les mitochondries (mitochondria-targeted). Diverses molécules anti-ROS, protéiques ou de petite taille, ont pu ainsi être modifiées par addition de groupements ou de séquences les guidant vers les mitochondries, leur permettant de franchir les membranes et les concentrant dans ces organelles. Cette opération est dénommée « targeting » (Hoye et al., 2008) en anglo-saxon, que l’on peut traduire par ciblage ou adressage, cette dernière appellation étant réservée aux protéines (adressing). Deux superbes articles sur le sujet sont parus en 2009 (Kagan et al., 2009a et 2009b).
1. Adressage vers les mitochondries de protéines antioxydantes
La surexpression de MnSOD dans des cellules par un transgène auquel on a greffé une séquence d’aminoacides « leader » conduisant cette MnSOD « entée » vers les mitochondries où elle s’accumule confère à ces cellules une radiorésistance remarquable à des rayonnements de 8 gray (puissants générateurs de ROS), alors que les mêmes expériences réalisées en utilisant un transgène non greffé par une séquence leader ne protègent pas (Epperly et al., 2003). La surexpression de la catalase greffée par une séquence peptidique nantie d’un tropisme mitochondrial a fourni des résultats semblables alors que la surexpression de la catalase simple était inefficace ; la surexpression de la MnSOD et de la catalase, toutes deux équipées de leur séquence-leader, augmentait encore la radio-protection (Epperly et al., 2008).
2. Ciblage de peptides antioxydants vers les mitochondries
a) Les SS peptides : ce sont les peptides de Szeto-Schiller (SS peptides) (Zhao et al., 2004; Szeto, 2006b) qui ciblent la membrane interne des mitochondries indépendamment du potentiel membranaire. Leur motif de structure est une alternance de résidus aromatiques et d’acides aminés basiques (arginine et lysine qui présentent deux NH2). Ces petits peptides traversent librement la membrane cellulaire et sont dirigés vers les mitochondries où ils atteignent la membrane interne. Leurs propriétés antioxydantes semblent très efficaces pour lutter contre le « swelling » mitochondrial et l’apoptose intrinsèque déterminés par des stress oxydants (Szeto, 2006a et 2006b). Les premières expériences ont été dirigées pour lutter contre les neurodégénérescences produites par des stress oxydants (Szeto, 2006a), puis pour améliorer l’état des organes en voie de transplantation, notamment le pancréas, en luttant contre l’apoptose qui menace les îlots de Langerhans (Thomas et al., 2007).
b) Le pentapeptide V5 : c’est en se basant sur un concept semblable qu’une équipe japonaise utilise un petit peptide traversant aisément les membranes : le Val-Pro-Met-Leu-Lys (peptide V5), qui protège de l’apoptose les cellules des îlots pancréatiques (Rivas-Carrillo et al., 2007). Ces petits peptides se concentrent 1000 fois contre la membrane interne des mitochondries.
3. Ciblage de molécules antioxydantes vers les mitochondries
On a essayé de définir les propriétés que devraient avoir de petites molécules pour être dirigées vers les mitochondries et y être concentrées. Par exemple, le bromure de triphényl phosphonium représenté sur la figure VIII-8 et qui est fortement « mitotargeted » est un cation hydrophobe. Mais tous les cations hydrophobes n’offrent pas ces avantages et la recherche demeure empirique dans ce domaine. La gramicidine est une molécule très « mitotargeted ». On en a utilisé la partie efficace pour la coupler au 4-AT (TEMPO : 2,2,6,6-tétraméthyl-pipéridine-1-oxyl), nitrone très utilisée en résonance paramagnétique électronique pouvant, selon le potentiel redox du milieu, agir commme accepteur d’électron (Mitchell et al., 2000; Wipf et al., 2005; Soule et al., 2007).
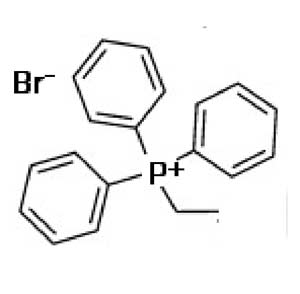
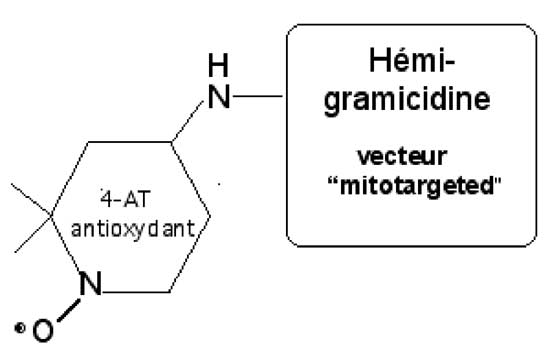
| Fig. VIII-8 : A gauche : le bromure de triphényphosphonium ; à droite : le vecteur « mitotargeted » provient de la gramicidine et permet une concentration intramitochondriale de 4-AT (TEMPO) plusieurs centaines de fois supérieure à celle du cytosol (Kagan et al., 2009b). |
Les chimistes ont lié le cation lipophilique TPP au tocophérol et obtenu un composé antioxydant, la mitovit E, se concentrant dans la mitochondrie dans l’espace intermembranaire où se situent les couples cyt c/cardiolipines (Murphy et Smith, 2007). L’accumulation est due à la charge positive qui est fonction du ΔΨm. La mitovit E est efficace contre la peroxydation des cardiolipines, alors que la vitamine E est sans effet protecteur (Smith et al., 1999). De telles combinaisons ont été réussies, unissant le TPP à un ubiquinol (Mito Q) ou à un acide lipoïque, puissants antioxydants (Smith et al., 1999; Murphy et Smith, 2007; Biasutto et al., 2008; Leo et al., 2008; Smith et al., 2008; Trnka et al., 2008; Skulachev et al., 2009).
Les résultats obtenus avec le Mito Q ont convaincu une industrie pharmaceutique à le commercialiser. Les applications de Mito Q, utilisé par voie orale, à la maladie de Parkinson et aux déficiences hépatiques en sont à la phase II des essais cliniques (Tauskela, 2007).
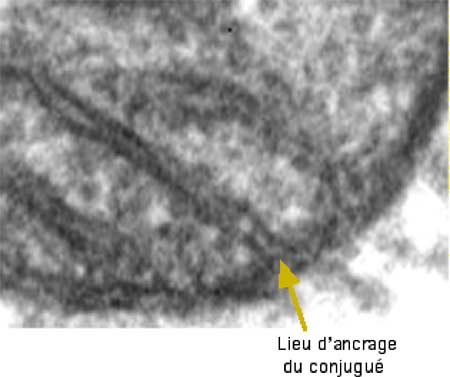
Fig. VIII-9 : Localisation dans les espaces intermembranaires mitochondriaux du conjugué TPP-4-AT.
Le TPP peut être conjugué à une nitrone qui va s’accumuler dans les espaces intermembranaires.
Les aminoxyls, dont le représentant le plus connu est le TEMPO (4-AT), sont des donneurs de •NO, qui inhibent l’activité peroxydasique du complexe cyt c/CL (Kagan et al., 2005). Rappelons que le •NO inhibe également les lipoxygénases, la cyclooxygénase et la peroxydation des lipides par l’hémoglobine (Kanner et al., 1992).
C’est un autre donneur de •NO couplé à une molécule de TPP : le (2-hydroxyamino-vinyl)-TPP qui est d’abord oxydé par le complexe cyt c/CL et libère un •NO qui, en retour, inhibe la fonction peroxydasique (Caro et al., 2001; Kagan et al., 2009b).
4. Régulation de l’ouverture du canal K+ATP
Les opioïdes et les anesthésiques volatils (dérivés du fentanyl) qui permettent d’obtenir de spectaculaires effets de cardioprotection agissent par une potentiation de l’ouverture du canal K+ATP (voir chapitre IV de la seconde partie). L’ouverture du K+ATP mitochondrial est activée par les ROS et le •NO (Weber et Schlack, 2008). Les inhibiteurs de la NOS diminuent le préconditionnement par opioïdes (Weber et Schlack, 2008), de même que certains anti-ROS (génistéine, propofol, etc …) (Weber et Schlack, 2008).
Mitochondrie et oxygénation - Sommaire |
Troubles de l'oxygénation et mitochondries - Sommaire |
Mitochondries et métabolisme de l'oxygène - Introduction |
 |
 |
 |