 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)  Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'Oxygène et la Vie: Tome II - L'Oxygène en Pathologie des Mammifères
Mitochondries et métabolisme de l'oxygène
Seconde partie : Troubles de l'oxygénation et mitochondries
Carol Deby
| Note: pour la facilité de la lecture, 1. chaque référence dans le texte comporte un lien vers les pages de bibliographie 2. les abréviations et les formules chimiques sont reprises dans les pages du glossaire ; elles sont également identifiées directement dans le texte (apparition en arrière plan lors du pointage de la souris) |
1. Description
C’est Ames et al. qui décrivirent le phénomène pour la première fois, en 1968 (Ames et al., 1968).
Lorsque l’on soumet une région du cortex cérébral à une ischémie de plus de 5 minutes et qu’on rétablit la circulation, des zones du tissu cérébral restent non irriguées. Ces expériences montrèrent que c’est lors de la reperfusion que les troubles d’obstruction apparaissent et sont liés à la présence de sang; lorsqu’on reperfuse la zone ischémiée avec un sérum salin véhiculant des particules de carbone pour suivre la progression du flux de liquide, on constate qu’une ischémie de 15 minutes est fort bien tolérée (figure I-1).
Les examens histologiques montrent que, lorsque les capillaires ne laissent plus passer le flux sanguin, les cellules endothéliales sont gonflées (swelling), bouchant la lumière du vaisseau, tandis qu’apparaît un œdème périvasculaire. Ces observations ont conduit les auteurs à supposer que c’est pendant la reperfusion par le sang que s’établissent les lésions.
Le No-reflow fut confirmé pour la circulation cérébrale dans les années qui suivirent, notamment par Harrison et al. en 1975. Rappelons que le phénomène ne s’observe que dans les territoires irrigués par une artère terminale, dans le cerveau, dans le myocarde et dans l’intestin. Krug et al. avaient déjà décrit ce phénomène au niveau du myocarde en 1966 ; Kloner et al. confirmèrent ces travaux en 1974.
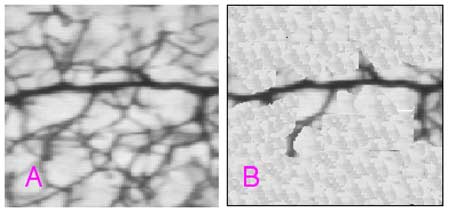
| Fig. I-1 : Réseau vasculaire irrigué par une artère terminale.
A. Le vaisseau principal avant le clampage ; le réseau vasculaire est visible de par le sang qui l’irrigue.
B. Après un clampage de plus de cinq minutes, le réseau n’est plus visible. Par contre, si au lieu de déclamper, on perfuse une suspension d’encre de Chine diluée dans une solution salée isotonique, le réseau devient à nouveau visible, même après 15 minutes d’ischémie (d’après Ames et al., 1968).
|
En 1974, Kloner et al. définissaient le phénomène de no-reflow au niveau cardiaque comme « une perfusion myocardique inadéquate à travers un segment donné de la circulation coronarienne, sans évidence angiographique d’obstruction mécanique ».
Reffelmann et collaborateurs reprennent leurs travaux sur le « no-reflow » en 2002 (Reffelmann et Kloner, 2002) et 2003 (Reffelmann et al., 2003) et simplifient leur définition en 2004 (Reffelmann et Kloner, 2004) : « incapacité de perfuser une portion du myocarde après la réouverture d’une artère coronaire préalablement occluse ».
Plus récemment, Reffelmann et Kloner (2006) proposent : « reperfusion incomplète et non uniforme au niveau microvasculaire malgré une réouverture adéquate de l’artère proximale après une période d’ischémie transitoire ».
Les premières observations de no-reflow chez l’homme datent de 1985 (Schofer et al., 1985). Mais il a fallu attendre 2005 pour qu’une étude anatomo-pathologique paraisse sur le sujet (Kawano et al., 2005).
Particularités du phénomène au niveau du myocarde : l’infarctus n’apparaît qu’après une ischémie de plus de 30 minutes. En dessous de ce seuil, la reperfusion peut entraîner deux complications graves :
- le no-reflow,
- le « stunning » ou sidération myocardique.
Plus faciles à circonvenir sont les arythmies (Argaud et al., 2005b).
Il a fallu longtemps pour que tous les chercheurs admettent que des lésions nécrotiques s’établissent durant le stade de reperfusion, c’est-à-dire lors de la réoxygénation. C’est à la fin du siècle dernier que l’on commence à étudier les phénomènes d’apoptose qui se déclenchent durant ce stade de reperfusion ; on constate aussi que les mitochondries sont liées à ces réponses de réoxygénation. Une conception révolutionnaire émergerait de ces interprétations : le préconditionnement.
2. Conceptions actuelles
C’est dans les années 1980 que le concept de lésions se produisant durant la reperfusion fut tout à fait admis et constitue le no-reflow; ces troubles se produisent essentiellement au niveau de la microvasculature :
1. Vasoconstriction artériolaire.
2. Œdème des cellules endothéliales et myocardiques restreignant la lumière vasculaire (Kloner et al., 1974).
3. Envahissement des vaisseaux par les leucocytes qui amènent des protéases, des leucotriènes et des ROS.
4. Participation des plaquettes produisant thromboxanes et sérotonine et aggravant la stase par agrégation (plutôt rare).
5. Mort des cellules endothéliales libérant histamine et kinines.
6. Hémolyse et libération de produits formés par la dégradation de l’hémoglobine dont les hèmes et leurs dérivés oxydés (ions ferryles, etc …) qui viennent aggraver l’action des ROS (Kaminsky et Proctor, 1989).
7. Récemment, des chercheurs (Inagaki et al., 2003a et 2003b; Ikeno et al., 2007; Wilson et Diaz, 2007) ont incriminé, chez la Souris, la protéine kinase C (PKC) contre laquelle certaines lignées expriment un inhibiteur dans leur myocytes, le dV1-1, qui exerce un effet protecteur. Des lignées de souris n’exprimant pas la PKC ont une survie nettement améliorée.
8. La reperfusion est une « épée à double tranchant » ; d’une part, elle rétablit l’oxygénation et apporte les nutriments, d’autre part, elle aggrave le dysfonctionnement vasculaire dans la zone ischémiée (Braunwald et Kloner, 1985; Ikeno et al., 2007).
Le no-reflow se produirait chez 30 % des patients lors de la reperfusion (Ito et al., 1996).
En 2004, Chaitman et Lim concluaient un éditorial en affirmant qu’il fallait approfondir l’étude du « no-reflow » en recherchant des méthodes permettant de restaurer plus rapidement le flux microcirculatoire, d’éviter les embolies distales, ce qui permettrait de réduire les lésions d’ischémie-reperfusion (voir chapitre III de cette deuxième partie).
Deux ans auparavant, une étude attribuait à l’ouverture du canal K+ATP le mécanisme endogène de lutte contre le « no-reflow » et non à la présence de •NO (Genda et al., 2002). Toutefois, les auteurs de cette publication affirmaient que l’hypercholestérolémie neutraliserait l’efficacité de ce moyen de protection.
Troubles de l'oxygénation et mitochondries - Chapitre II: Anoxie-réoxygénation |
Mitochondries et métabolisme de l'oxygène - Introduction |
 |
 |
 |