 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)  Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'Oxygène et la Vie: tome II - L'Oxygène en Pathologie des Mammifères
Mitochondries et métabolisme de l’oxygène
Première partie : Mitochondries et oxygénation
Carol Deby
Chapitre II : Phosphorylation oxydative
| Note: pour la facilité de la lecture, 1. chaque référence dans le texte comprend un lien vers les pages de bibliographie 2. les abréviations et les formules chimiques sont reprises dans les pages du glossaire; elles sont également identifiées directement dans le texte (apparition en arrière plan lors du pointage de la souris) |
1. Généralités
Lecture générale : D. Voet, J.G. Voet, et G. Rousseau. Biochimie. 2d édition, De Boeck Université, 2007.
La phosphorylation oxydative est une consommation d'oxygène (respiration mitochondriale) associée à une phosphorylation de l'adénosine diphosphate (ADP) en adénosine triphosphate (ATP). L'oxygène consommé joue le rôle d'accepteur terminal d'électrons et de protons. La fixation d'un phosphate sur l'ADP absorbe une certaine quantité d'énergie. Les ATP sont des accumulateurs d'énergie chimique, sortant des mitochondries et participant à des réactions endothermiques où ils fournissent l'énergie nécessaire en perdant un phosphate et en redevenant de l'ADP. L'image centenaire des molécules de graisse et de sucres "brûlant" dans les cellules pour fournir l'énergie nécessaire pour les grands phénomènes biologiques, mouvement, croissance, multiplication, défense, est expliquée: ces molécules ne brûlent pas par combinaison directe avec O2, ce qui entraînerait une libération immédiate et totale d'énergie élevant la température à des valeurs incompatibles avec la vie. Une molécule d’oxygène réduite par réaction directe avec 4 atomes d’hydrogène libère 483,2 kJ (équation II.1).
L'énergie potentielle du métabolite sera lentement libérée par une cascade de réactions enzymatiques qui la dissipera en "paquets" de moins de 100 kilojoules qui seront immédiatement utilisés pour la phosphorylation des molécules d'ADP. Au bout de cette chaîne de réactions, une molécule d'oxygène acceptera 4 électrons de bas niveau énergétique et quatre protons.
La pression normale de l'oxygène au niveau de la mitochondrie est 0,3 kPa (2 Torr) ce qui correspond à 3 μM d’O2 (Gnaiger, 2003). Exposer des mitochondries isolées à la pression d'oxygène atmosphérique réalise, on le voit, une forte hyperoxie.
Trois étapes sont à distinguer dans ces phénomènes complexes (Saraste, 1999) :
1) La constitution de "pools " de co-facteurs enzymatiques : le FADH2 et le NADH ; le cycle de Krebs se déroulant dans la matrice assure leur réduction tout en fournissant des protons et des électrons de haute énergie. Ces cofacteurs sont indispensables au fonctionnement de la cascade de réactions libérant par paliers l'énergie des électrons : ils se trouvent aux deux portails d'entrée de la chaîne de transport d’électrons.
2) Le transport des électrons vers l'oxygène ou ETC.
3) L'absorption continue des "paquets" d'énergie pour la phosphorylation de l'ADP, par l'ATPsynthase.
A. Le transport des électrons (Electron Transport Chain : ETC)
Il s'agit des électrons de haute énergie chimique provenant du cycle de l'acide citrique ou cycle de Krebs.
Simultanément, ce cycle libère des protons et des molécules de CO2, au cours de réactions exothermiques qui se déroulent à des potentiels redox d'abord très négatifs. Les électrons sont accompagnés d'une libération d'énergie (loi de Gibbs). A chaque étape de la chaîne (qui en comprend 4), de telles libérations d'énergie se produiront. Le phénomène s'arrêtera au complexe IV (cytochrome oxydase) où, de manière instantanée, s'effectue la réduction complète des molécules d'oxygène, du côté matriciel :
O2+ 4e- + 4 H+ → 2H2O + 115,6 kCal (II.1)
L'énergie de cette réaction in vitro (combustion d’un jet d’hydrogène dans l’air) est très élevée, provoquant une température très élevée, incompatible avec la vie : elle dégage 115,6 kCal ou 483,2 kJ ou 3.1018 MeV (voir ci-dessous, tableau des équivalences énergétiques).
Dans la mitochondrie, les électrons perdent progressivement leur énergie qui est utilisée par l'ATP synthase et la réaction finale ne produit qu'une faible élévation de température, car la chaleur dégagée est considérablement plus faible (voir chapitre IV), mais chez les homéothermes, elle entretient une température située entre 36,5°C et 39°C.
1 J(oule) = 6,24.1018 électrons-volt(eV) ou 6,24.1012M(éga)eV 1kJ = 6,24.1015MeV 1 kCal = 2.61. 1022 eV = 2,61. 1016 MeV 1 cal = 4,18 J(oules) 1 kCal = 4,18 kJ = 2,61. 1016 MeV |
B. La phosphorylation oxydative (OxyPhos)
Elle a lieu dans le complexe V (CoV) ou ATP synthase qui fragmente l'énergie dégagée lors du transport d'électrons et l'accumule en créant une liaison riche en énergie avec un groupe phosphate (Pi pour phosphate inorganique), au cours de la réaction enzymatique :
ADP + Pi + énergie ⇒ ATP (II.2) (figure II.1)
NB : à pH 7, Pi est présent sous forme d’un mélange équilibré de phosphates, H2PO4- et HPO42-
Ces molécules d'ATP sont de petits accumulateurs d'énergie qui se répandent dans le cytosol et permettent à de nombreuses réactions endothermiques de se produire.
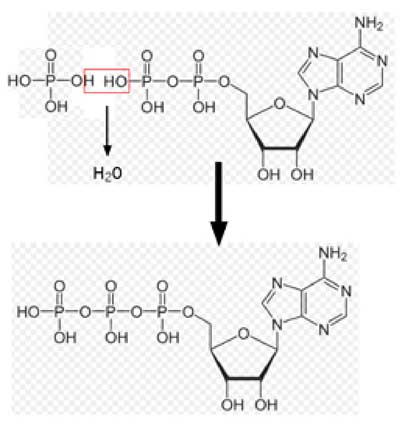
| Fig. II-1 : Phosphorylation de l’ADP (partie supérieure) par une molécule d’acide phosphorique (H3PO4), libérant une molécule d’H2O, et produisant l’ATP (partie inférieure). Sur cette figure, il n’a pas été tenu compte de l’ionisation des fonctions OH des phosphates. |
C. Le schéma de la chaîne de transport d'électrons (ETC)
C'est dans le début des années 1960 qu'un groupe de chercheurs de l'Université du Wisconsin découvrirent la structure de l'ETC en solubilisant les membranes mitochondriales et en les fractionnant (Green et al., 1966).
Quatre complexes métalloprotéiques sont fixés dans la membrane interne : le complexe I (CoI), le complexe II (CoII), le complexe III (CoIII) et le complexe IV (CoIV).
Les électrons libérés par le cycle de Krebs intra-matriciel entrent par deux portails dans la chaîne respiratoire : le système enzymatique NADH-FMN oxydase fixé sur le CoI et la FAD succinate déshydrogénase fixée sur le CoII. Les deux flux d'électrons aboutissent à une petite molécule fixée dans la membrane interne, le coenzyme Q (CoQ ou ubiquinone10).
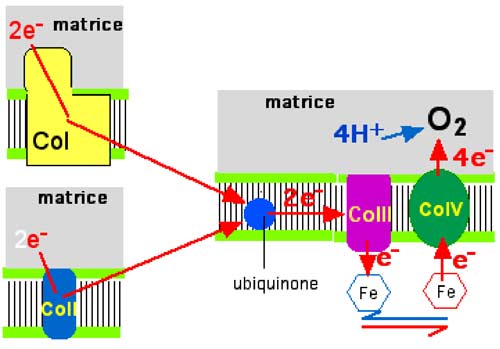
| Fig. II-2 : L'entrée des électrons provenant du cycle de Krebs se fait par le complexe I (CoI) ou le complexe II (CoII). Chacun des deux complexes donne ses électrons à l'ubiquinone. De là, les e- entrent dans le complexe III, puis réduisent le fer hémique de molécules mobiles du cytochrome c. Celles-ci sont alors oxydées par le CoIV et retournent chercher un électron auprès du CoIII. Le cytochrome c se comporte comme une navette de transport, opérant dans l'espace intermembranaire. Finalement, les électrons sont utilisés par le pôle matriciel du CoIV pour réduire une molécule d'oxygène en 2 molécules d'eau. |
Une différence de potentiel électrique existe de part et d'autre de la membrane interne. Elle est créée par les pompes à protons qui réalisent un gradient chimiosmotique (ΔΨm exprimé en volts ; voir plus bas : hypothèse de Mitchell) entre l'espace intermembranaire et la matrice, provoquant une polarisation entre les deux faces de la membrane, celle du côté matriciel étant négative par rapport à l’autre (plus de 100 mV). Ce gradient assurera le fonctionnement de l'ATP synthase (CoV) (Hüttemann et al., 2008) qui dissipe ce gradient en permettant la rentrée de protons et libère l'énergie nécessaire à la phosphorylation de l'ADP par l'enzyme.
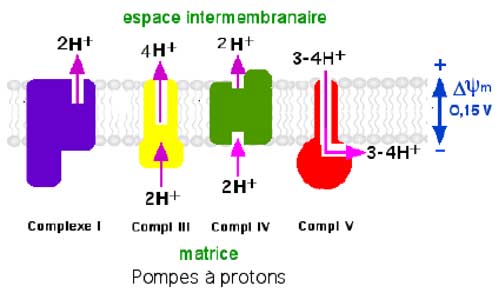
| Fig. II-3 : Vue d'ensemble des pompes à protons (O’Rourke et al., 2005). |
Une différence de potentiel électrique ΔΨm est maintenue entre les deux faces de la membrane interne des mitochondries grâce à la plus haute concentration de H+ dans l’espace intermembranaire (Carreras et al., 2004; Fernandez-Vizarra et al., 2009).
Le transport d'électrons depuis les complexes I et II libère une énergie aisément calculable: celle-ci est utilisée pour pomper des protons de la matrice vers l'espace intermembranaire. 3 pompes à protons, localisées au sein des complexes I, III et IV, fonctionnent ainsi. Un excès de charges positives s'accumule sur la face intermembranaire de la membrane interne (gradient d'énergie).
Le retour des H+ se fera via un canal traversant l'ATP synthase (Complexe V) lui fournissant l'énergie nécessaire pour créer une liaison de haute énergie entre la molécule d'ADP et un nouveau phosphate. Ce canal permet également le transit du phosphate inorganique en provenance de l’espace intermembranaire, indispensable à la synthèse d’ATP.
◊ Hypothèse de Mitchell (1961) : Peter Mitchell proposa qu’un gradient électrochimique est utilisé pour la production d’ATP et est le mécanisme supportant la phosphorylation oxydative ; c’était l’hypothèse chimiosmotique qui fut une des plus fécondes du XXe siècle (Hüttemann et al., 2008), mais qui rencontra un grand scepticisme durant la décennie 1960. Mitchell reçut le Prix Nobel en 1978.
◊ Gradient chimiosmotique 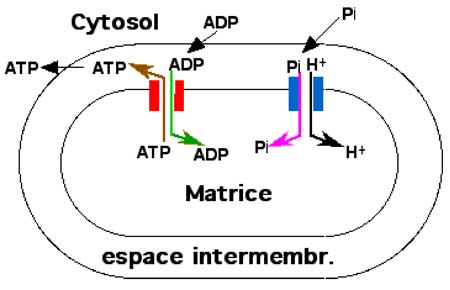
| Fig. II-4 : Schéma récapitulatif des transports transmembranaires de l’ADP et de l’ATP. Dans la membrane interne, un sas échangeur (rouge), sous contrôle du ΔΨm, permet l’entrée de l’ADP dans la matrice et la sortie de l’ATP. L’entrée du phosphate inorganique Pi se fait grâce au gradient de pH (sas bleu). |
Les deux premiers facteurs permettent à l’ATP synthase de fonctionner grâce au flux de protons qui reviennent dans la matrice par un canal traversant le coenzyme V ; la différence de pH facilite l’entrée dans la matrice, par des canaux spécifiques, de l’ADP et des protons.
Les complexes I, III, et IV sont des pompes à protons liées au potentiel redox, ce qui signifie que les transferts d'électrons au travers des enzymes sont couplés à un accroissement de l'énergie potentielle des protéines elles-mêmes, de telle manière que leurs changements conformationels soient associés à une conduction d'un flot de protons unidirectionelle (vectorielle) à travers la membrane. Trois conditions sont nécessaires pour une translocation valable des protons par ces enzymes (Schultz et Chan, 2001):
(a) une liaison au potentiel redox,
(b) une "porte" à électrons,
(c) une "porte" à protons.
E. L'oxydo-réduction de l'ubiquinone 10 (voir James et al., 2005)
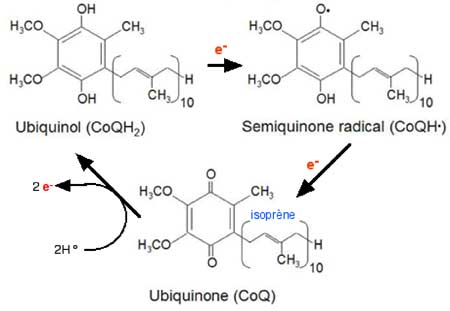
Fig. II-5 : Oxydo-réduction de l'ubiquinone 10 (CoQ).
UQH2 + e- ⇒ UQH• + e- ⇒ UQ ou UQH2 + 2e- ⇒ UQ (II.3a)
UQ + 2 H ⇒ UQH2 + 2e- (II.3b)
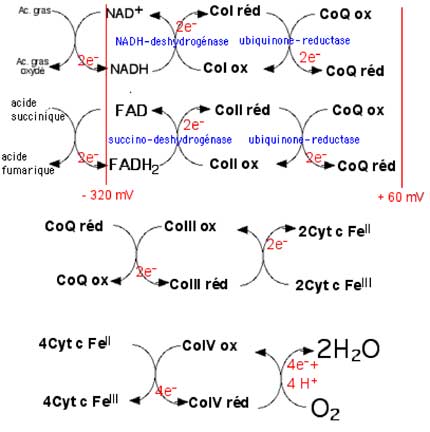
| Fig. II-6 : Schéma général des oxydo-réductions se succédant après l'entrée d'électrons soit par le portail du CoI, soit par celui du CoII. Ces réactions sont modérément exothermiques, libérant de petites quantités d'énergie qui seront utilisées par un complexe adjacent au système ETC, l'ATP synthase (équation II.2). Cyt c : cytochrome c. |
F. L'oxydo-réduction des protéines à fer et à soufre
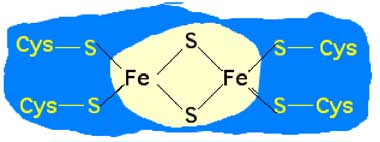
Fig. II-7 A : Protéine à fer et soufre : centre du type 2Fe-2S.
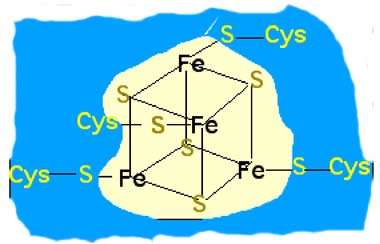
Fig. II-7 B : Protéine à fer et à soufre: centre de type 4Fe-4S.
G. Le cytochrome c
Cet hème est une protéine hydrosoluble, assez abondante dans les espaces intermembranaires, qui transporte les électrons de CoIII à CoIV. Elle s'ancre successivement à la membrane près du CoIII, puis du CoIV, par l'intermédiaire d'une cardiolipine (voir plus loin, figure II.13) anionique (voir chapitre VIII).
Pour une revue, voir Iverson et Orrenius, 2004.
2. Description des complexes
A. Complexe I ou NADH-CoQ oxydo-réductase ou NADH-Déshydrogénase
C’est le portail le plus important (Galkin et Moncada, 2007).
Les paires d'électrons qui pénètrent par cette entrée résultent des oxydations suivantes :
malate ⇒ oxaloacétate + 2H+ + 2e- ;
isocitrate ⇒ α-cétoglutarate + 2H+ + 2e- ;
α-cétoglutarate ⇒ succinyl-CoA + 2H+ + 2e-
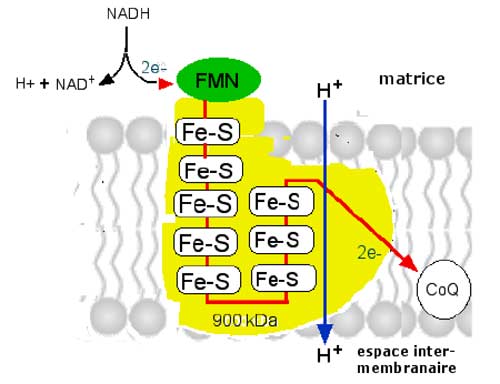
Fig. II-8 : Schéma du complexe I (portail à NADH-FMN)
Ce complexe en forme de L a une très grande taille (env. 900 kDa); il est formé de 3 modules, totalisant 45 sous-unités différentes (Carroll et al., 2006) :
1. Le module N : il constitue l'entrée des électrons, provenant du NADH, qui seront transportés, via le FMN, par une chaîne de 5 à 6 clusters à Fe et à S. Il est constitué de 3 sous-unités, pesant 75, 51 et 24 kDa. Le module 51 lie de manière non covalente le FMN. L'ensemble exerce les activités d'une NADH oxydase flavoprotéinique.
2. Le module Q, comprenant 3 Fe-S, qui livre les électrons au CoQ et montre les activités d'une quinone réductase (Brandt, 2006 ; Carroll et al., 2005 et 2006).
3. Le module P qui est un canal de transport de protons (flèche bleue), pompant ces cations de la matrice vers l'espace interstitiel en utilisant l’énergie provenant du transfert d’électrons du NADH vers l’ubiquinone.
NADH (-320 mV) - FMN - (Fe-S)8 - CoQ (+ 60 mV)
La différence de potentiel entre NADH et CoQ est de 380 mV.
◊ Pompe à proton : d'après des récents travaux sur procaryotes, le rapport entre protons éjectés de la matrice vers les espaces intermembranaires et les électrons transportés serait (Brandt et al, 2003) : 4H+ / 2e-.
◊ Nitrosation du complexe I (Galkin et Moncada, 2007)
Nous verrons, au chapitre III, le rôle capital que joue le •NO et ses dérivés, notamment les nitrosothiols, sur le CoIV (cytochrome oxydase), mais l'équipe de Moncada a démontré dès 1998 que le •NO peut provoquer la nitrosation du complexe I (Clementi et al., 1998). Tout récemment, Galkin et Moncada ont apporté une importante correction aux premières observations: seule la forme inactivée du CoI est susceptible d'être inhibée par les nitrosothiols.
Dans les préparations de mitochondries, deux formes existent, de structure distincte ; l'une est complètement active catalytiquement ; c'est la forme A. L'autre, la forme D (de-activated), n'effectue pas le transit des électrons, ni l'extrusion des H+, sinon avec une phase de latence bien marquée qui peut être raccourcie par addition de NADH (5-10 mM). C'est cette forme qui est inhibée par les nitrosothiols. La forme D apparaît durant l'exposition des préparations à plus de 30°C alors que l'action catalytique ne peut avoir lieu, faute de substrat.
◊ Protection des -SH du complexe I (Hurd et al., 2008)
A la surface du complexe I se trouvent de nombreuses fonctions thiols qui peuvent interagir avec les -SH du pool de glutathion intramitochondrial, avec comme conséquence des dommages oxydatifs, source de nombreuses pathologies. En effet, les -SH libres de la surface du complexe constituent une défense contre les ROS qui se forment durant l'activité du CoI. Leur oxydation en disulfures expose le complexe à une progression des oxydations. Les résidus cystéinyls Cys-531 et Cys-704 sont préservés par une glutathionylation.
B. Complexe II ou succinate déshydrogénase
Ce complexe enzymatique oxyde le succinate en fumarate, libérant 2 électrons et 2 protons qui réduisent le cofacteur FAD (voir figure II-9).
Ce portail a une taille nettement plus petite que le premier (130 kDa) et comprend 4 sous-unités; il ne contribue pas à l'expulsion de protons de la matrice vers l'espace intermembranaire.
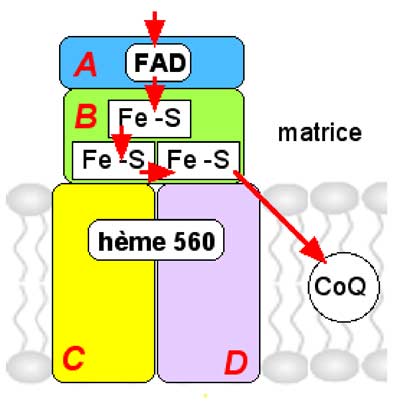
Fig. II-9 : Itinéraire des électrons dans le CoII, marqué par les flèches rouges.
Les 4 parties du CoII sont :
A. Le site catalytique : une flavoprotéine à FAD.
B. Un ensemble de 3 protéines à fer et soufre de 27 kDa, transportant les électrons. Il s'agit de "clusters" contenant 2Fe-2S, 4Fe-4S et 3Fe-4S (Cecchini, 2003). Cette partie B transfère directement les électrons à l'ubiquinone.
C et D forment un site dimérique ne comprenant qu'un hème 560 chez les mammifères et servant d'ancrage. Le rôle de l'hème est encore inconnu (Cecchini, 2003).
C. Complexe III ou CoQ-Cyt c oxydoréductase ou complexe bc1
C'est l'ancien cytochrome b.
C'est un homodimère pesant 2 x 300 kDa et constitué de 2 x12 unités.
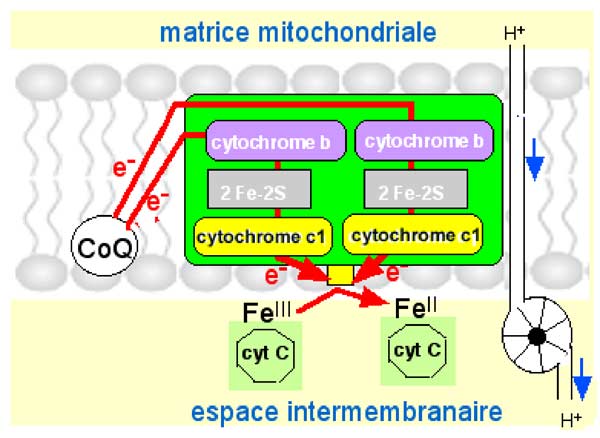
| Fig. II-10 : Complexe III : chaque paire d'électrons libérée par l'oxydation du CoQ (ubiquinone 10) est disjointe, les e- la constituant étant transportés sur deux modules jumeaux. Chaque module est formé de 3 éléments : cytochrome b, 1 cluster 2Fe-2S et le cytochrome c1. Les deux voies convergent vers un même point d'embarquement (docking : carré jaune) où le cytochrome c peut venir s'arrimer et être réduit avant de migrer vers le CoIV. |
Cette réduction s'accompagne d'une libération d'énergie :
2e- + 2cyt c(FeIII) => 2cyt c(FeII) + 39 kJ/mole (II.4)
Les 39 kilojoules/mol dégagés sont précisément la quantité d'énergie nécessaire pour pomper un proton depuis la matrice vers l'espace intermembranaire, à travers la membrane interne. Ce pompage constitue une importante fonction du CoIII, dénommé le cycle Q (Schägger, 1995).
D. Complexe IV ou cytochrome oxydase ou CcO
Le complexe IV, ou cytochrome -oxydase, est un dimère constitué de deux moitiés identiques.
Chacune comprend une sous-unité I ou a et une sous -unité II ou a3 (figure II-11).
Chaque sous-unité renferme un hème couplé à un atome de cuivre Cu.
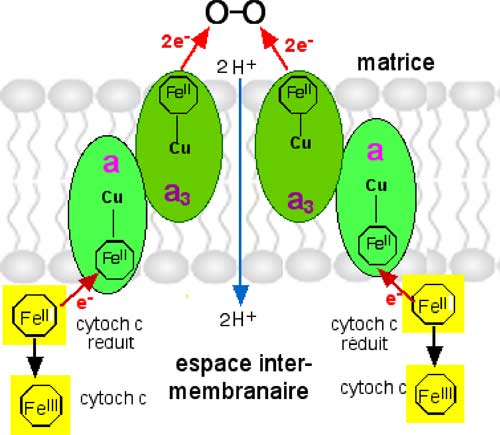
| Fig. II-11 : La cytochrome–oxydase. Les cytochromes c, une fois réduits, quittent leur ancrage qui les liait au CoIII et livrent leurs électrons aux deux points de réduction du CoIV. |
C'est au niveau de l'émergence de a3 hors de la membrane, dans la matrice, que se fait la réduction de la molécule d'oxygène par 4 électrons (équation II.1).
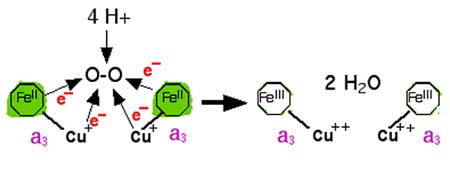
| Fig. II-12 : Réduction instantanée et complète de la molécule d'oxygène, sans intermédiaires radicalaires ou réactionnels. En vert : hèmes réduits. Les atomes de cuivre sont complexés chacun par 3 résidus histidyls (Cooper, 2002). |
Un canal à protons existe également dans le complexe IV.
Une partie des unités du CoIV est codée dans le mitDNA, l'autre dans le noyau (Vijayasarathy et al., 2003).
◊ Rôle régulateur du complexe IV : étant le terminus de l'ETC, le CoIV conditionne le débit de cette dernière et contrôle la respiration mitochondriale et la phosphorylation oxydative (Capaldi, 1990).
Son activité propre est modulée :
- par la pO2 (Chandel et Schumacker, 2000; Dagsgaard et al., 2001; Merle et Kadenbach, 1982; Vijayasarathy et al., 2003),
- par la protéine kinase A (PKA) (Prabu et al., 2006) qui phosphoryle certaines sous-unités,
- par les variations d'apport en cardiolipine ou la modification de celle-ci par des lipoperoxydes (Prabu et al., 2006).
◊ Cardiolipines
Voir : Hatch, 1998 ; Houtkooper et Vaz, 2008.
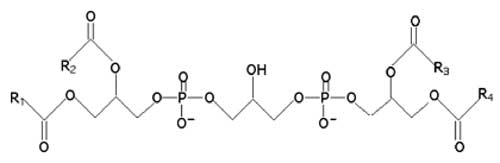
Fig. II-13 : Schéma général d'une cardiolipine ; R : chaîne grasse.
Les cardiolipines représentent 30% du contenu lipidique des mitochondries; certaines sont localisées sur le côté matriciel de la membrane interne. Celle qui sert d'ancre au cytochrome c est spécifique de l'espace intermembranaire (Fariss et al., 2005). Ces lipides jouent un rôle très important dans l’apoptose.
Les cardiolipines sont presque caractéristiques des mitochondries, car dans les cellules, près de 80% de ces lipides sont localisés dans ces organelles ; là, ils sont distribués entre la matrice et les espaces intermembranaires, dans la proportion 60:40 (Fernandez et al., 2002 ; Kagan et al., 2006).
◊ Structure : les cardiolipines sont des molécules porteuses de deux charges négatives. Avec leurs quatre chaînes grasses, ces molécules peuvent faire théoriquement un très grand nombre de combinaisons (de l’ordre de 104), mais chez les mammifères, ces combinaisons sont étonnamment limitées. C’est l’acide linoléique qui prédomine (Kagan et al., 2006).
◊ Le complexe IV est un senseur de l'oxygène
Hypothèse de Chandel et al. (1997, 2000), confirmée par Budinger et al. (1998), le CoIV est un "sensor" de pO2. Une chute de celle-ci détermine des cascades de signaux, notamment en direction du noyau, activant par exemple l'expression de la NO synthase; des réponses tissulaires sont également stimulées. La mitochondrie est ainsi impliquée dans le phénomène d'adaptation à l'hypoxie.
E. Complexe V ou ATPsynthase ou F0-F1
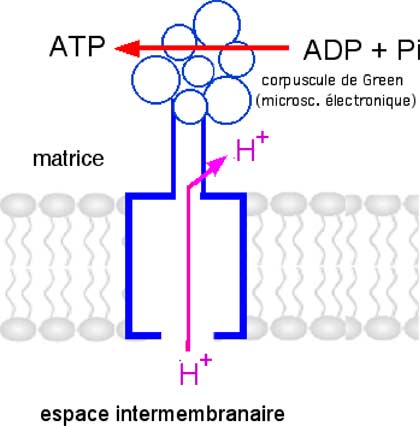
Fig. II-14 : Complexe V, lieu de synthèse principal de l'ATP cellulaire.
La tête du complexe fait largement saillie dans la matrice où elle est visible en microscopie électronique (corpuscule de Green). Les 11 sous-unités formant le complexe pèsent 450 kDa. Il constitue une pompe à protons fonctionnant en sens inverse des autres pompes de la chaîne respiratoire, le flux allant de l'espace intermembranaire vers la matrice.
3. Couplage et découplage de la respiration
Voir : Jezek et Garlid, 1998 ; Starkov, 2006.
A. Couplage
La création d'ATP, accumulateur d'énergie distribué dans tous les lieux cellulaires où se passent des réactions endergoniques, est donc liée à la perte d'énergie des électrons libérés par le cycle de Krebs et acheminés par la chaîne respiratoire mitochondriale jusqu'à leur port final: l'oxygène.
La consommation d'oxygène et la production d'ATP sont donc associées : c'est le phénomène de couplage de la respiration à la phosphorylation, ou phosphorylation oxydative.
Dans les conditions normales, 3 molécules d'ATP sont formées en même temps qu'un atome d'oxygène se combine à 2 électrons, en travaillant sur des préparations mitochondriales in vitro (Skulachev, 1998).
B. Découplage
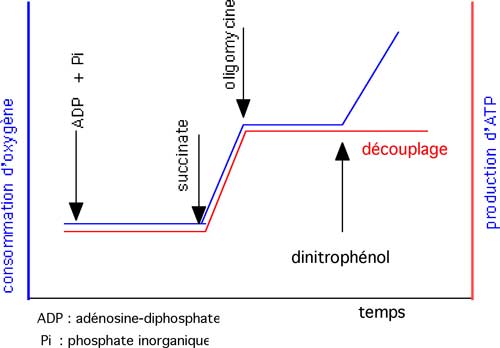
| Fig. II-15 : Découplage pharmacologique de la respiration mitochondriale par le dinitrophénol. La respiration, dans les mitochondries isolées, est déclenchée par le système ADP + Pi + succinate. Elle est stoppée par l’oligomycine. Le dinitrophénol produit le redémarrage de la consommation d’oxygène, tout en paralysant la production d’ATP : il n’y a plus de phosphorylation ; il y a fuite de H+ et l’énergie se dissipe en chaleur. Courbe bleue : consommation d’oxygène ; courbe rouge : production d’ATP. |
1. Découplage physiologique
Le retour des protons dans la matrice ne se fait pas uniquement par le canal de CoV (ATP synthase) mais aussi par d’autres voies. On parle d’une « fuite de protons » (« proton leak ») dont l’énergie se dissipe en chaleur. On dénomme maintenant cette « fuite », conductance basale des protons (CBP). Le mécanisme de la CBP reste inexpliqué. Cependant, il semblerait que ce phénomène diminuerait le potentiel de membrane, abaissant ainsi la production de ROS (Brand et al., 2002).
Les protéines découplantes sont des protéines de transport ionique mitochondriales qui catalysent une perte régulée de protons à travers la membrane interne, détournant de l’énergie libre utilisée par l’ATP synthase.
Trois protéines découplantes (UCP : Uncoupling Protein) ont été isolées (Ricquier et Bouillaud, 2000 ; Blanc et al., 2003) :
- l’UCP-1 isolée du tissu brun où elle joue un rôle thermogénique. L’UCP-1 (Uncoupling Protein 1) est exclusivement exprimée dans le tissu adipeux brun et est un facteur de la thermogenèse en réponse aux stimulations béta-adrénergiques (Ricquier et Bouillaud, 2000).
- l’UCP-2 et l’UCP-3 sont deux homologues de l’UCP-1 et sont plus largement distribuées, particulièrement UCP-2 (Pecqueur et al., 2001). Les souris déficientes en UCP-2 et en UCP-3 surproduisent des ROS. La déficience en UCP-2 entraîne une hypersécrétion d’insuline (Blanc et al., 2003).
Ces deux dernières UCP semblent donc jouer un rôle prédominant dans la production des ROS, en inhibant celle-ci (Arsenijevic et al., 2000 ; Brand et al., 2002 ; Zackova et al., 2003 ; Echtay, 2007 ; Beck et al., 2007; Sack, 2006).
Dès 1997, un effet régulateur de la protéine-2 sur la production mitochondriale de peroxyde d'hydrogène (H2O2) (effet ralentisseur) avait été observé par Negre-Salvayre et collaborateurs (Negre-Salvayre et al., 1997).
Une activation des protéines découplantes est déclenchée par l'anion superoxyde matriciel (Murphy et al., 2003; Talbot et al., 2004 ; Seifert et al., 2008).
• Rôle des acides gras.
Korshunov et al. (1998) leur assignent un effet découplant lorsque la mitochondrie est au repos, empêchant la production de ROS. Les acides gras actifs sur la CBP seraient des oméga-3.
2. Découplage toxique
Le dinitrophénol (DNP) est un agent découplant qui pénètre dans la matrice et augmente fortement la consommation d’oxygène. L’énergie libérée par l’ETC n’est plus utilisée par l’ATP synthase et est convertie en chaleur (Korde et al., 2005).
Mitochondrie et oxygénation - Chapitre III:Régulation de l'ETC et de l'OxPhos |
Troubles de l'oxygénation et mitochondries - Sommaire |
Mitochondries et métabolisme de l'oxygène - Introduction |
Courrier |
 |
 |
 |