 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)  Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'Oxygène et la Vie: Tome II - L'Oxygène en Pathologie des Mammifères
Mitochondries et métabolisme de l'oxygène
Première partie : Mitochondries et oxygénation
Carol Deby
| Note: pour la facilité de la lecture, 1. chaque référence dans le texte comporte un lien vers les pages de bibliographie 2. les abréviations et les formules chimiques sont reprises dans les pages du glossaire ; elles sont également identifiées directement dans le texte (apparition en arrière plan lors du pointage de la souris) |
Les mitochondries sont maintenant considérées comme principales sources de ROS dans les cellules (Orrenius et al., 2007 : Turrens, 2003 ; Wolin et al., 2005 ; Jezek et Hlavata, 2005; Zhang et Gutterman, 2007; Ueda et al., 2002 ; Guarnieri, et al., 1992 ; Cadenas et Davies, 2000 ; Aon et al., 2007). Nous ajouterons ce correctif : " … dans les cellules non inflammatoires. Par contre, dans les neutrophiles, les macrophages activés et certains lymphocytes, la source principale de ROS est cytosolique, de par les activités de la NADPH oxydase et de la myéloperoxydase".
Cette production centralisée de ROS est due au fait que la mitochondrie est le lieu central de consommation de l'oxygène durant la phosphorylation oxydative.
Les espèces oxygénées activées sont des produits normaux de l'activité mitochondriale et participent aux phénomènes de régulation et d'homéostasie cellulaires (Dröge, 2002). Elles régulent notamment la genèse des facteurs anti-hypoxiques HIF (Qutub et Popel, 2008) .
Mais les mitochondries semblent contenir les cibles les plus vulnérables aux ROS (Orrenius et al., 2007).
1. Bref rappel sur les ROS
Les Reactive Oxygen Species (ROS) sont définies dans le chapitre VII de l’Initiation au Métabolisme de l’Oxygène. Il s'agit de toute molécule provenant de l'activation de l'oxygène moléculaire.
Ces espèces oxygénées activées sont impliquées dans les dysfonctionnements consécutifs à une ischémie, mais jouent des rôles physiologiques en déterminant la durée de vie cellulaire, par leur contribution à la surcharge calcique (Ichas et al., 1997) et en modulant la perméabilité mitochondriale (Aon et al., 2003) ; elles agissent sur la concentration en calcium et sur l'apoptose (Duchen, 1999; Murphy, 2001).
A. L'anion superoxyde, précurseur des ROS
L'anion superoxyde, O2•, est la principale espèce radicalaire des mitochondries.
C'est la première étape de la réduction de l'oxygène qui peut conduire aux ROS les plus agressives. Elle est monoélectronique et endothermique et nécessite donc une fourniture d'énergie ; elle n'est donc pas spontanée et exige la participation d'une enzyme, une oxydase.
Etant polarisé, l'anion superoxyde ne peut traverser les membranes hydrophobes, sauf en empruntant les canaux anioniques (Gus'kova et al., 1984 ; Han et al., 2003; Hawkins et al., 2007). La plus grande partie de O2• est déversée, par les canaux IMAC, dans les espaces intermembranaires (St-Pierre et al., 2002) où se situent les enzymes antioxydantes (voir chapitre IV). L'anion superoxyde est très instable et dismute rapidement en H2O2. Sa durée de vie est pourtant suffisamment longue pour la rencontre avec une molécule de monoxyde d'azote (•NO) avec laquelle il forme le peroxynitrite et par cette voie, le radical hydroxyle. La présence de superoxyde dismutase (SOD) permet une dismutation 1000 fois plus rapide, diminuant ainsi considérablement les chances de rencontre de O2• avec •NO.
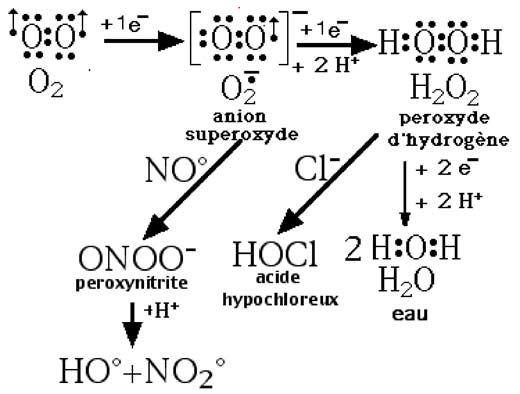
| Fig.VI-1 : Schéma résumé des principales espèces oxygénées activées (ROS). L’anion superoxyde, en présence de NO synthase, s’additionne au •NO pour produire l’instable peroxynitrite, lequel génère le très fugace radical hydroxyle •OH, puissant agent de réactions radicalaires en chaîne dont les cycles de lipoperoxydation. Quant au peroxyde d’hydrogène, il génère, en présence de myéloperoxydase, l’acide hypochloreux, puissant oxydant qui agit par chloration |
.
On considère l'anion superoxyde comme "un sous-produit inévitable" de l’ETC (Jezek et Hlavata, 2005; Orrenius, 2007). Sa concentration en steady-state serait 5 à 10 fois plus élevée que dans le cytosol (Cadenas et Davies, 2000).
1. Lieu principal de génération d'anion superoxyde
Le site exact où se produit cette réduction monoélectronique de l’O2 fait toujours l'objet de débats (Jezek et Hlavata, 2005). Le dosage de l'anion superoxyde lui-même est sujet à erreur vu sa rapidité de conversion en H2O2 et la présence de Mn-SOD (Fridovich, 1997).
Certains considèrent que le complexe I est le principal générateur de ROS in vitro, dans la mitochondrie intacte (Turrens et Boveris, 1980). O2• se forme dans la matrice (Brand et al., 2004).
Plus récemment, c’est le couple CoI–CoQ qui a été proposé pour ce rôle, le radical semi-ubiquinone (voir chapitre II, figure 5) paraissant bien être le centre le plus favorable à la génération d'O2• (fig. VI-2) (Muller et al., 2003 ; St-Pierre et al., 2002; Turrens, 2003). O2• reste dans la matrice (Brand et al., 2004).
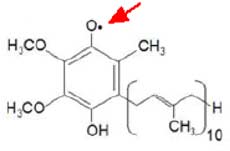
Fig. VI-2 : Le radical semiquinone (la flèche rouge marque l’électron célibataire).
Le complexe III devient la source principale d'O2• si la respiration mitochondriale est supprimée par l'antimycine, inhibiteur spécifique du complexe III (Boveris et al., 1976; Cadenas et al., 1977 ; Turrens et Boveris, 1980). Dans ce cas, O2• apparaît des deux côtés de la membrane interne (Han et al., 2001; Starkov et Fiskum, 2001 ; Muller et al, 2004). On sait depuis 1985 que c'est la semiubiquinone qui constitue le donneur d'e- pour la réduction monoélectronique du complexe III (Turrens et al., 1985).
Enfin, on reconnaît au complexe II un rôle non négligeable (Brand et al., 2004; Cadenas et Davies, 2000; Genova et al., 2001; de Grey, 2002; Genova et al., 2003; Inoue et al., 2003; Raha et Robinson, 2000; Kushnareva et al., 2002 ; Turrens, 2003).
2. Les autres sites où sont produits les anions superoxydes
En dehors de l'ETC, la glycérolphosphate déshydrogénase (membrane interne) libère O2• (Drahota et al., 2002) ; la déshydro-orotate déshydrogénase (matrice) génère également de l'anion superoxyde (Forman et Kennedy, 1976). Enfin, Hauptman et al. (1996) et Cadenas et Davies (2000) ont montré que la monoamino-oxydase (sise sur le côté interne de la membrane externe) jouait un rôle semblable.
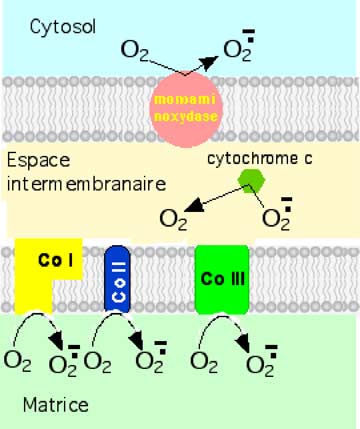
Figure VI-3 : Les lieux de production de l’anion superoxyde dans la mitochondrie.
3. Importance de O2• dans le « signaling »
Dès 1993, Hennet et al. avaient mis en évidence le rôle important joué par l’anion superoxyde dans les mécanismes de transduction du signal, particulièrement dans celui par lequel le TNF-α joue un rôle régulateur.
4. Importance de O2• dans l’apoptose
Comme nous le verrons au chapitre VII, l’anion superoxyde, non seulement facilite l’ouverture du mPTP, mais induit la sortie rapide du cytochrome c, agent déclencheur de l’apoptose intrinsèque (Madesh et Hajnóczky, 2001).
5. Une découverte récente : les « flashes » de O2•
Utilisant un nouvel indicateur d’O2•, une protéine circulaire fluorescente, la cpIFP, Wang et al. ont mis au point une technique qu’ils affirment être non seulement très sensible, mais spécifique de l’anion superoxyde (Wang et al., 2008). Ils ont mis en évidence des éclairs de fluorescence qui témoigneraient d’une production intense de courte durée, non seulement dans les cellules en culture, mais aussi dans les mitochondries isolées.
B. Le peroxyde d'hydrogène H2O2
C'est la seconde étape dans la voie de réduction de l'oxygène. H2O2 est peu réactionnel en soi, mais la présence d'atomes de fer complexé ou d'hème provoquera une sorte de réaction de Fenton, particulièrement agressive (voir ci-dessous). Ce danger explique l'abondance d'enzymes attaquant le peroxyde d'hydrogène : GSH peroxydase, thiorédoxine-2, catalase, peroxyrédoxine-3 … (voir chapitre IV et chapitre VIII).
H2O2, contrairement à l’anion superoxyde, traverse aisément les membranes cellulaires (Nordberg et Arnér, 2001).
C. Le monoxyde d'azote •NO et le peroxynitrite ONOO-
Voir chapitre III de Mitochondries et Métabolisme de l’Oxygène et chapitre VII de l’Initiation au Métabolisme de l’Oxygène.
D. Le problématique radical hydroxyle •OH et/ou l'ion ferryle FeIVO2
Ils peuvent produire des radicaux peroxyles et alkoxyles (voir chapitre IX de l’Initiation au Métabolisme de l’Oxygène).
2. ROS : actions normales et pathologiques
Dans les mitochondries, la forme la plus abondante de ROS est l'anion superoxyde.
Durant près d'un demi-siècle, les ROS ont été considérées comme nocives et médiatrices de divers grands processus pathologiques, comme le vieillissement et l'athérosclérose : les ROS jouaient uniquement un rôle pathologique. Contrairement à cette conception qui prévaut encore dans certains milieux scientifiques, les ROS ne sont pas nécessairement nocives et peuvent intervenir normalement dans certains processus biochimiques et physiologiques (Katoh et al., 1999; Nemoto et al., 2000).
A. Effets physiologiques
Des concentrations optimales peuvent exister, produisant des effets normaux, favorables à la bonne marche de la vie cellulaire (Jezek et Hlavata, 2005).
L'affinement des techniques de biologie moléculaire et l'approfondissement de la biochimie mitochondriale ont permis de faire un distinguo assez révolutionnaire pour les pionniers du métabolisme de l'oxygène. Les ROS jouent un rôle indispensable dans cette fonction récemment découverte : la transmission du signal. Rappelons brièvement qu'une cellule fait partie d'un tissu et que cet ensemble peut, selon sa spécialisation, jouer un rôle sécrétoire, se multiplier, se contracter ou se relâcher, etc… En période de croissance, des groupes cellulaires doivent disparaître par apoptose.
Des messagers extracellulaires (messagers humoraux ou premiers messagers) déclenchent un signal par action sur un récepteur transmembranaire qui, en changeant de structure, initiera un signal qui va se propager dans la cellule jusqu'aux sites effecteurs, grâce à des seconds messagers intracellulaires. Grâce à ces mécanismes, une bonne coordination s'établit dans le comportement des cellules constitutives d'un tissu. Les mitochondries sont souvent impliquées dans ces processus, notamment l'apoptose, et utilisent les ROS comme étapes normales.
1. Intervention dans la signalisation
L'importance des ROS dans ces mécanismes est de mieux en mieux démontrée (Brookes et al., 2004 ; Liang et al., 2005).
La production de ROS régulatrices est impliquée dans les circuits de signalisation provenant de récepteurs, dans l'activation des transcriptions et dans la prolifération des cellules normales (Huang et al., 1996 ; Simon et al., 2000 ; Brookes et Darley-Usmar, 2002; Brookes et al., 2004).
La production de ROS est indispensable durant l'embryogenèse et un accroissement des ROS dans des cellules particulières provoque l'apoptose requise pour l'élimination tissulaire durant la morphogenèse (Salas-Vidal et al., 1998).
2. Mitochondries et hypoxie : c'est par l'intermédiaire de ROS d'origine mitochondriale que l'hypoxie active les facteurs protéiques HIF de protection (Hypoxia-Induced Factors) (Chandel et al., 2000 ; Schroedl et al., 2002).
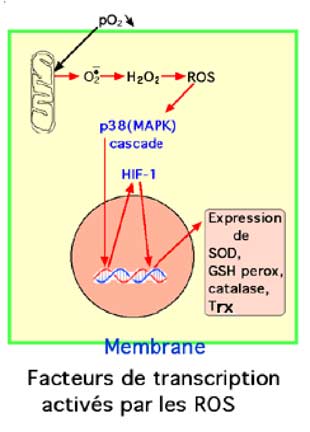
| Fig. VI-4 : Rôle de la mitochondrie dans l’activation des facteurs de transcription. pO2 : pression partielle en oxygène; MAPK : mitogen-activated protein kinase; HIF: hypoxia-induced factor; SOD: superoxide dismutase; GSH perox: glutathion peroxydase; Trx: thiorédoxine. |
3. Le cas particulier du peroxyde d’hydrogène
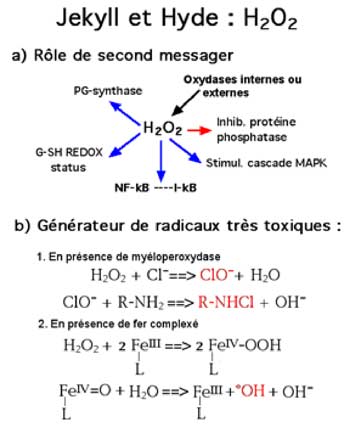
Fig. VI-5 : Le double rôle du peroxyde d’hydrogène (H2O2).
Flèches bleues : stimulation ; flèche rouge : inhibition.
FeIV-OOH est relativement stable ; •OH ne dure que quelques nanosecondes.
H2O2 est maintenant considéré comme un messager intracellulaire ubiquitaire agissant à des concentrations subtoxiques (Rhee et al., 2005). Déjà, en 1979, Deby et Deby-Dupont montraient l’effet stimulant de concentrations d’H2O2 inférieures à 10-6M sur la biosynthèse in vitro des prostaglandines. Plus tard, on démontra que la transduction du signal produit par le PDGF (Platelet-Derived-Growth Factor) exige la présence d’H2O2 (Sundaresan et al., 1995), tandis que l’EGF (Epidermal Growth Factor ) induit la production du peroxyde d’hydrogène dans les cultures de cellules épidermoïdes (Bae et al., 1997 ; Song et al., 2007).
B. Effets pathologiques des ROS dans la mitochondrie
Si la balance redox de la cellule est affectée par une élévation trop marquée des ROS, des dommages peuvent être causés aux structures biologiques par ces agents oxydants. Des concentrations anormales de ROS dans les mitochondries peuvent amorcer l'apoptose, via l'ouverture du mégapore, libérant le cytochrome c dans le cytosol. Le déséquilibre de la balance antioxydants/oxydants en faveur de ces derniers a été impliqué dans le vieillissement et dans diverses maladies dégénératives, comme nous le verrons plus loin.
◊ Le RIRR (ROS-induced ROS release)
Les mitochondries peuvent montrer une excitabilité anormale aux effets des ROS exogènes, répondant aux élévations anormales de leur concentration par un accroissement de leur production en ROS (Zorov et al., 2000 ; Brady et al., 2006). Ce phénomène peut s’accomplir selon deux voies (Brady et al., 2006), l’une impliquant l’ouverture du mPTP (que nous verrons en détail au chapitre VII), l’autre celle de l’IMAC (étudié au chapitre V). Le RIRR est impliqué dans plusieurs processus cardiopathiques (Zorov et al., 2000).
◊ Cibles des ROS (Orrenius, 2007) :
- acides nucléiques
- phospholipides
- protéines à SH
- protéines à Fe et à S
1. Toxicité du cytochrome c libéré (Tuominen et al., 2002 ; Iverson et Orrenius, 2004 ; Ostrander et al., 2001 ; Atlante et al., 2000)
L’action principale de cette protéine hémique libérée dans le cytosol est d’amorcer l’apoptose (voir chapitre VII).
2. Atteinte des cardiolipines (Fariss et al., 2005)
Fig. VI-6 : Exemple de cardiolipine.
Peroxydation de la cardiolipine complexant le cytochrome c : le cytochrome c est retenu dans l’espace intermembranaire, pour assumer sa fonction de transporteur d’électrons dans l’ETC, par une cardiolipine ; en présence d’H2O2, cette dernière peut être peroxydée, provoquant la rupture du complexe et la libération du cytochrome c qui peut gagner les espaces périmitochondriaux et initier un processus apoptotique (voir chapitre VII).
Il est vraisemblable que c’est l’hème du cytochrome c qui joue le rôle de peroxydase, générant des états radicalaires comme l’ont montré Kagan et al. (2006): un radical tyrosyle protéique et le spectre caractéristique du radical pentadiényle, formé sur une chaîne linoléyle, sont visibles.
3. Déclenchement d’une surproduction de mitROS
Nous appelons mitROS les espèces oxygénées produites dans la mitochondrie.
A. L’hyperglycémie
Elle induit une surproduction de ROS par les mitochondries (Nishikawa et al., 2000).
B. Les leptines (Yamagishi et al., 2001)
Ce sont des hormones circulantes en provenance du tissu adipeux qui stimulent la production d’anion superoxyde dans les cellules aortiques.
C. L'hypoxie et l'ischémie tissulaire :
Voir seconde partie : Troubles de l’Oxygénation et Mitochondries.
Notons que l'hypoxie commence au-dessous du seuil de 3 μM O2 (Gnaiger, 2003).
1. La diminution d'apport d'O2 dans les tissus myocardiques, musculaires et pulmonaires
Cette diminution
est un facteur d'élévation de la production de ROS (Dirmeier et al., 2002 ; Lesnefsky et Hoppel, 2003; Jezek et Hlavalta, 2005; Chandel et Budinger, 2007).
2. L'ischémie et l'hypoxie
L'ischémie cardiaque provoque des lésions de l'ETC, mais l'inhibition réversible du complexe I par l'amobarbital protège la partie distale de la chaîne (Chen Q et al., 2006).
Lipton (1999) a particulièrement mis en évidence les conditions de production de ROS dans les neurones ischémiés.
D. L'inhibition de la respiration mitochondriale
Elle stimule la production mitochondriale de ROS (Brown et Borutaite, 2007; St-Pierre et al., 2002; Turrens et al., 1985; Turrens, 2003). L'antimycine, inhibiteur du complexe III, élève la production de l’anion superoxyde, comme nous l’avons vu plus haut dans ce chapitre (Boveris et al., 1976; Cadenas et al, 1977).
E. L'ion Ca2+
Il influe sur la production de ROS par :
1. stimulation du cycle de Krebs : le flux d'électrons augmente dans l'ETC, entraînant une surproduction d’anion superoxyde.
2. stimulation de la NO synthase (chapitre III.2) : rappelons que le •NO inhibe l'ETC au niveau du CoIV. Ces deux éléments sont synergiques pour augmenter la production d'anion superoxyde.
F. Stimulation du cycle de Krebs par certains toxiques
Les dioxines stimulent la succinodéshydrogénase et augmentent la production d'H2O2 (Senft et al., 2002a et 2002b).
4. Modulation de la production d’anion superoxyde
A. Le découplage (Brand et al., 2004; Starkov, 2006) est un système de dissipation d'énergie limitant la production de ROS (voir chapitre II.3).
B. Le rôle des variations du potentiel redox : voir chapitre IV.
Mitochondrie et oxygénation - Chapitre VII:Rôle des mitochondries dans l'apoptose |
Troubles de l'oxygénation et mitochondries - Sommaire |
Mitochondries et métabolisme de l'oxygène - Introduction |
 |
 |
 |