 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'Oxygène et la Vie: Tome II - L'Oxygène en Pathologie des Mammifères
Mitochondries et métabolisme de l'oxygène
Première partie: Mitochondries et oxygénation
Carol Deby
Chapitre III : Régulation de la chaîne de transport des électrons (ETC) et de la phosphorylation oxydative (OxyPhos)
Note: pour la facilité de lecture, |
Divers agents physiologiques interviennent pour réguler la respiration mitochondriale et, directement ou indirectement, la production d'ATP.
Des travaux de l’équipe de Boveris et al. (2000), on peut déduire que 3 grands facteurs interviennent dans la régulation de la respiration mitochondriale :
- la pression d'oxygène tissulaire (pO2), exprimable en molarité ;
- le monoxyde d'azote, •NO ;
- l'apport d'ADP.
Certains auteurs affirment que la mélatonine et la N-acétyl-5-méthoxykynurénamine (aMK) peuvent également intervenir.
Enfin, un facteur qui apparaît de plus en plus capital est l'environnement redox qui sera traité à part, dans le chapitre IV.
1. Molarité de l'oxygène
Rappelons que la molarité de l'oxygène au niveau de la mitochondrie, dans la cellule, est de 3μM selon Gnaiger (2003).
Ce facteur est très controversé. On a admis qu'un degré élevé de respiration mitochondriale pouvait être conservé à une valeur constante malgré des variations importantes de la molarité de O2 allant de 5-30 μM (gamme usuelle) à 0,8 μM (hypoxie): le rôle de la pO2 n'apparaîtrait que dans les états d'hypoxie sévère. Or, un nouveau concept semble prévaloir depuis quelques années : le contrôle ne dépendrait pas seulement de la pO2, mais aussi du monoxyde d’azote.
Au niveau de la cytochrome oxydase, le •NO entre en compétition avec l'oxygène. A de hautes pressions d'O2, l'inhibition par •NO est forte, tandis qu'à pressions basses, l'inhibition due au monoxyde d'azote s'abaisse pour tendre vers zéro. Ainsi, de grandes variations de la pO2 n'ont que de faibles retentissements sur la phosphorylation oxydative. Ce n’est qu’à très basse pression d'O2 que la respiration commence à diminuer significativement (Chandel et al., 1996 ; Poderoso et al.,1996).
En 2003, Alvarez et al. ont observé, sur membranes submitochondriales, que la concentration en oxygène retentit sur le fonctionnement des NOS, mais varie selon le tissu :
- pour le foie, le KmO2 pour les mitNOS est 40 μM O2, correspondant à une Vmax de 0,51 nmol •NO/min ;
- pour le cerveau, KmO2(mitNOS) = 73 μM O2, avec une Vmax de 0,49 nmol •NO/min ;
- pour le rein, KmO2(mitNOS) = 37 μM O2, avec une Vmax de 0,42 nmol •NO/min.
L’oxygène est lipophile et traverse sans contrôle les doubles membranes phospholipidiques.
2. Modulation par le •NO
Les travaux in vitro ont montré que le monoxyde d'azote présente une grande affinité pour la cytochrome oxydase, dont il est un inhibiteur réversible. •NO et O2 entrent en compétition pour le centre binucléaire cyt a3 – Cu (Torres et al., 1998).
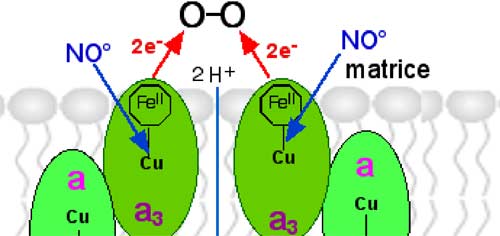
Fig. III-1 : Lieu d’action du •NO sur le CoIV (cytochrome–oxydase ; voir fig. II-11, chapitre II).
Compétition entre •NO et O2 au niveau du Cu des cytochromes a3.
Il apparaît certain que le •NO modifie in vivo les activités mitochondriales (Moncada et Erusalimsky, 2002). La régulation de la chaîne de transport d'électrons par le •NO a fait l'objet de nombreuses recherches depuis une dizaine d'années, montrant qu'en inhibant l'ETC, le •NO augmente la production d'anion superoxyde (Poderoso et al., 1996 et 1999; Brown, 1999 ; Boveris et al., 2000 ; Davidson et Yellon, 2005). Cette modulation de l’ETC par le •NO permet d’expliquer en partie les résultats obtenus par le préconditionnement (Shiva et al., 2007) (voir Partie II, Troubles de l'oxygénation et mitochondries).
Mais il faut d'abord examiner les enzymes produisant •NO (NO synthases ou NOS) au niveau des mitochondries. Il est conseillé au lecteur de consulter, dans le chapitre XIII de l’Initiation au Métabolisme de l'Oxygène, les éléments de la biochimie des NO synthases.
A. Les NO synthases mitochondriales (mitNOS)
Pour une revue récente : Haynes et al., 2004
Ce sont les travaux de Giulivi et al. (1998) qui ont, les premiers, mis en évidence l’existence de NO synthases dans les mitochondries. Mais il a fallu attendre plusieurs années pour que la communauté scientifique reconnaisse les mitNOS et que d’autres équipes se lancent dans leur isolement et leur purification.
1. Isoformes mitochondriales de la •NO synthase (NOS)
Le groupe de Giulivi et al. a mis en évidence, en 1998 (Tatoyan et Giulivi, 1998; Giulivi et al., 1998 ; Elfering et al., 2002), l'existence de NOS dans la mitochondrie isolée; la production de •NO par ces mitochondries isolées fut confirmée par d'autres laboratoires (Bustamante et al., 2000 ; Riobo et al., 2002; voir la revue de Haynes et al., 2004), et dès 1997, des isoformes spécifiques de la mitochondrie (mitNOS) avaient été décrites (Ghafourifar et Richter, 1997 ; Ghafourifar et al., 1999). Les NOS mitochondriales sont différentes de leurs équivalents cytosoliques (Tatoyan et Giulivi, 1998; Riobo et al., 2002 ; Kanai et al., 2001).
2. Role physiologique des mitNOS
Haynes et al. (2004) ont montré que, par la production de •NO, les NOS modulent la consommation en O2 des mitochondries. Par ce biais, le •NO, dont la production augmente en hypoxie et abaisse la phosphorylation oxydative, réduirait la formation de ROS (Lacza et al., 2001). Mais un effet inhibiteur prolongé peut entraîner des effets délétères, allant jusqu'à la libération du cytochrome c dans le cytosol, avec danger d'apoptose (voir Zhang et al., 2005 et le chapitre VII); aussi l'activité des mitNOS doit-elle être strictement régulée par des mécanismes homéostasiques.
Régulation de l'activité des mitNOS
La famille des mitNOS couvre un large spectre de protéines différentes, tant immunologiquement que structurellement, mais organisées pour être dirigées, après leur synthèse dans l’ergastoplasme de la cellule, vers les mitochondries. L’activité des mitNOS hépatiques et musculaires est régulée par la thyroïde, tandis que l’hypoxie module celle des cellules nerveuses et hépatiques (Riobo et al., 2002).
Le groupe de Blatter a mis en évidence le rôle positif du calcium dans la production de •NO (Dedkova et al., 2004) en utilisant la microscopie confocale à balayage laser et des colorants fluorescents sensibles au •NO; ces chercheurs ont montré une élévation de la production de •NO lorsque la concentration cytosolique du Ca2+ augmentait (Dedkova et al., 2004).
Les mitNOS maintiennent un « steady-state » mitochondrial de •NO (Giulivi et al., 1998).
L'activité des mitNOS est complètement inhibée par l'inhibiteur de la calmoduline, le calmidazolium, à 100 μmole/l (Lacza et al., 2001).
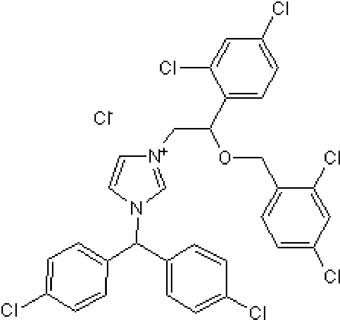
Fig. III-2 : Formule du calmidazolium.
3. Intervention des NOS cytosoliques
Des auteurs soutiennent qu'il y a un « docking » d'une NOS sur la membrane externe de la mitochondrie (Gao et al., 2004).
4. Un agent stimulant l’activité des mitNOS : les endotoxines (LPS)
Les endotoxines sont des lipopolysaccharides constitutifs des bactéries Gram négatives. Celles d’Escherichia coli peuvent pénètrer, dans des conditions pathologiques, dans la circulation sanguine après traversée de l’intestin. Mais elles peuvent être émises par des bactéries ayant produit des foyers infectieux ; le choc septique provoque une montée de l’endotoxémie et les traumas infectés peuvent être envahis par des microorganismes Gram négatifs.
Alvarez et Boveris (2004) ont montré que chez les rats « endotoxémiques », l’activité des NOS était significativement augmentée, de 90% dans les tissus musculaires du diaphragme et de 30% dans le muscle cardiaque.
B. Mécanisme d'action de •NO (voir Dahm et al., 2006)
Il faut distinguer l'action directe de •NO sur la cytochrome oxydase, qui est inhibitrice, mais réversible, et l'action indirecte de composés nitrés dérivant de •NO, tels que le peroxynitrite (ONOO-), NO2•, N2O3 et les S-nitrosothiols qui attaquent sélectivement et irréversiblement diverses cibles dans la chaîne respiratoire (Brown et Borutaite, 2004 et 2007).
1. Action directe de •NO
a. Fixation sur la cytochrome oxydase
Le •NO inhibe réversiblement cette enzyme, diminue la respiration mitochondriale et participe ainsi à un mécanisme de contrôle physiologique. •NO entre en compétition avec O2 (Brown et Cooper, 1994; Cleeter et al., 1994).
Cet oxyde d'azote agit à des molarités très faibles, de l'ordre de 10-9M (Brown et Cooper,1994 ; Cleeter et al.,1994). •NO se fixe sur le site liant l'oxygène dans le complexe IV :
Fe3+ + •NO ⇒ Fe2+…NO+
Cu2+ + •NO ⇒ Cu+…NO+ ; NO+ + H2O ⇒ NO2- + 2H+
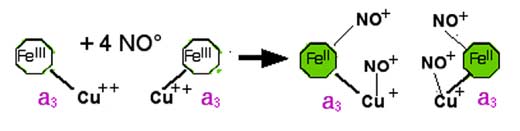
| Fig. III-3 : Réactions entre le •NO et les métaux des deux modules a3 du complexe IV (voir figure II-12). Noter que les fonctions NO+ sont promptement remplacées par des fonctions NO2-. •NO, ainsi que les fonctions NO+ et NO2- peuvent facilement se délier et libérer les métaux réduits, les rendant aptes à réduire l'oxygène (Brown et Borutaite, 2007) en formant l’anion superoxyde. |
b. Réaction avec les thiols : nitrosothiols (s-nitrosation)
Dans des thiols comme la cystéine ou le glutathion, H peut être substitué par une fonction nitroso NO, en présence d'un puissant accepteur d'électron tel une autre molécule de •NO, libérant un proton et un anion NO- (Beckman, 1996).
![]() (III-1)
(III-1)
Cette nitrosation peut évidemment se produire sur le -SH d'une cystéine (Cys) constitutive d'une protéine; ce phénomène est réversible et le couple dénitrosation/nitrosation peut dès lors servir comme régulateur dans les processus de transduction de signaux (Steffen et al., 2001). Dans les mitochondries, la haute teneur en glutathion (GSH) (voir chapitre IV) favorise la formation de GS-NO, permettant de diminuer la concentration en •NO et par là, la formation de ONOO- (Steffen et al., 2001). Il est établi que GS-NO est une des principales molécules nitrées à se former dans les conditions biologiques (Padjett et Whorton, 1997). Le GS-NO se décompose lentement en dégageant du •NO (Noble et al., 1999). Cette molécule est donc un moyen de transport du •NO (Steffen et al., 2001).
c. S-nitrosation des protéines
La formation de S-nitrosothiols à partir de protéines thiolées (P-SH) est soumise à des nitrosothiols comme le nitroso-glutathion, GS-NO (Dahm et al., 2006).
P-SH + G-S-NO ⇒ P-S-NO + GSH (III-2)
Lorsque deux SH voisinent sur la protéine, il peut se former un disulfure libérant la protéine de sa fonction NO (Dahm et al., 2006) :
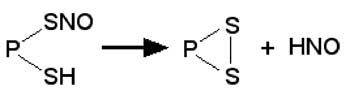 (III-3)
(III-3)
2. Action indirecte de •NO par ses dérivés
a. Peroxynitrite ONOO- (voir chapitre VII de l’Initiation au Métabolisme de l’Oxygène).
Rappelons que la rencontre d’une molécule de •NO avec une molécule d'anion superoxyde, O2•, produit une molécule de peroxynitrite. Un des découvreurs de la biologie du •NO, Louis Ignarro, consacre une page de son traité publié en 2000 aux actions de ONOO- produit dans les mitochondries (Ignarro, 2000). Sa formation est tout à fait vraisemblable puisque des mitNOS sont présentes et que O2• est produit physiologiquement par l'ETC :
•NO + (•O:O:)- ⇒ ONOO- (III-4)
Les complexes I, II et V sont inactivés irrémédiablement, mais non le complexe IV (CoIV, cytochrome–oxydase) lorsqu’il n’est pas isolé (Cooper, 2002 ; Cooper et al., 2003). Dans la mitochondrie intacte, le CoIV décompose le peroxynitrite par 2 électrons (Pearce et al., 1999)
ONOO- + 2 e- + H+ ⇒ NO2- + -OH (III-5)
à condition que la concentration de ONOO- soit faible, sinon le CoIV est détruit (Pearce et al., 1999).
Le peroxynitrite favorise l’efflux du Ca2+.
b. S-nitrosothiols : voir équation III-3
C. Rôle des NO synthases mitochondriales
On a constaté que la synthèse d’H2O2 était affectée par le •NO, notamment au niveau du foie ; cette effet s’opèrerait par action du •NO sur la consommation d’oxygène, par l’intermédiaire de la cytochrome-oxydase (Sarkela et al., 2001).
Plus tard, Carreras et Poderoso (2007) confirmèrent le rôle régulateur de •NO sur le contenu en H2O2, non seulement dans les mitochondries, mais dans le cytosol et dans le noyau.
Sur mitochondries isolées, l’addition d’arginine (substrat des NOS) induit une surproduction de •NO qui s’accompagne de la stimulation de la production d’H2O2, tandis que la respiration est inhibée. Par contre, l’utilisation d’un inhibiteur de NOS (L-NMMA), augmente la respiration et décroît la production d’H2O2, (Sarkela et al., 2001).
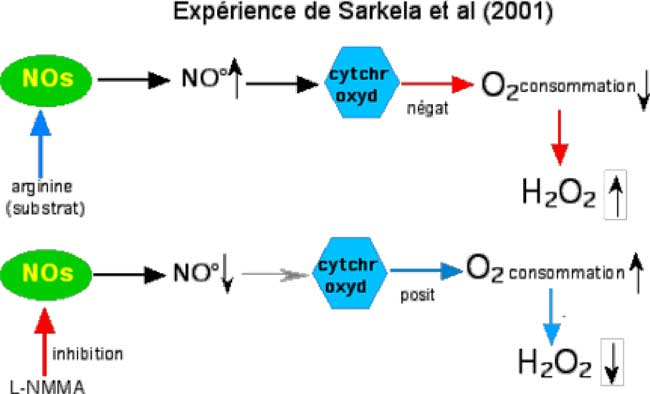
| Fig. III-4 : Ces expériences sont effectuées sur des mitochondries isolées. On effectue les mesures de consommation d’oxygène et de production d’H2O2. Schéma supérieur : addition de 0,1 mM de L-arginine, substrat des NO synthases (NOs). On constate une diminution de la consommation d’oxygène et une augmentation de la production d’H2O2. Les auteurs expliquent ces résultats par une augmentation de la production de •NO (phénomène bien connu et expliqué) qui ralentit l’activité de la cytochrome-oxydase (polygone bleu), ce qui occasionne un ralentissement de l’ETC et la diminution de la respiration. Schéma inférieur : addition de L-NMMA, puissant inhibiteur des NOs. La chute de production de •NO qui s’ensuit lève ou affaiblit l’inhibition de la cytochrome-oxydase, dont l’activité croît, entraînant une augmentation de la respiration. |
Alvarez et Boveris (2004) ont observé que, chez les rats injectés par LPS d’E. coli (10 mg/kg intrapéritonéal), la production d’H2O2, par rapport à des témoins ayant reçu un placebo, était multipliée par un facteur allant de 2 à 3, tandis que l’activité de la MnSOD était multipliée par un facteur 2.
Mécanisme hypothétique de la production d’H2O2 en présence de •NO
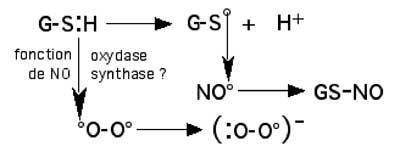
| Fig. III-5 : Hypothèse d’une fonction oxydase sur les NOS, avec transfert d’un électron sur une molécule d’oxygène, produisant l’anion superoxyde. |
Les thiols, en présence de •NO et d’un agent électrophile puissant comme l’oxygène, forment un radical thiyl (G-S•) qui est instantanément immobilisé en nitrosothiol. Ce serait une exception à l’inertie de O2 à l’état fondamental (voir Initiation au métabolisme de l'oxygène). Le rôle d’une NO synthase ayant simultanément une propriété d’oxydase est envisageable.
D. Action combinée de •NO et des ions Ca2+
Jekabsone et al. (2003) ont observé que les ions Ca2+ agissent synergiquement pour inhiber l’activité du complexe I. Ce phénomène est complètement inhibé par l’addition de superoxyde dismutase, ce qui laisse supposer que le peroxynitrite est à la base de l’inhibition constatée. Le couple Ca2+/•NO provoque également la sortie extra-mitochondriale du cytochrome c, première étape de l’apoptose intrinsèque (voir chapitre VII).
E. Régulation de la production de •NO dans les mitochondries
Des travaux récents ont démontré que la cytochrome c oxydase module la production du •NO endogène par les mitNOS (Palacios-Callender et al., 2004 et 2007). Ceci constitue un mécanisme feedback où deux antagonistes s’autorégulent : dans le cas actuel, il s’agit de la cytochrome c oxydase et du •NO.
3. L'apport d'ADP et de phosphate inorganique.
Depuis les travaux de Chance et al. (1955), l’importance de l’apport d’ADP dans le contrôle de la respiration mitochondriale n’a cessé de croître. Ce nucléotide a été considéré durant de nombreuses années comme le régulateur de la respiration (Scheibye-Knudsen et Quistor, 2009).
Mais des travaux ultérieurs ont montré qu’au niveau du foie, c’est l’ion phosphate qui doit être considéré comme le régulateur de la respiration plutôt que l’ADP (Tanaka et al., 1989). Les recherches toutes récentes de Scheibye-Knudsen et Quistor (2009) ont montré que les ions phosphate sont aussi importants que les molécules d’ADP dans le contrôle de la respiration.
4. Rôle de la mélatonine et de l'aMK
Fig. III-6 : Mélatonine
Selon Acuña-Castroviejo et al. (2003), la mélatonine et son métabolite, la N-acétyl-5-méthoxykynurénamine (aMK) réguleraient physiologiquement l’ETC et la phosphorylation oxydative.
La mélatonine contrecarrerait l’action inhibitrice des LPS sur les complexes I et IV qui s’opère par excès de production de •NO (voir ci-dessus), son effet étant d’autant plus important que l’animal est âgé (Escames et al., 2003). L’interprétation fournie pour expliquer le comportement de cette molécule est son action antioxydante, ce dont nous doutons fortement (voir Initiation, chap. XV).
5. Rôle de l'environnement redox
La question fait l’objet du chapitre IV.
Soulignons dès maintenant le rôle assigné par des travaux récents au rapport glutathion réduit/glutathion disulfure qui, dans les conditions normales, est de 300/1, mais qui peut s’abaisser, entraînant une baisse progressive du ΔΨm, avec, aux environs de 50/1, un brutal collapsus (Aon et al., 2007). Autre fait marquant: l’état redox du NAD(P)H (Starkov et Fiskum, 2003).
6. Conclusions du chapitre III
Persistence de contradictions : certains auteurs soutiennent que l’augmentation d’activité des NOS, en inhibant l’ETC, diminuerait la production des espèces oxygénées activées ; inversement, d’autres groupes soutiennent que l’inhibition des NOS diminuerait cette production.
Mitochondrie et oxygénation - Chapitre IV:Phénomènes redox mitochondriaux |
Troubles de l'oxygénation et mitochondries - Sommaire |
Mitochondries et métabolisme de l'oxygène - Introduction |
 |
 |
 |